XiaoMi-AI文件搜索系统
World File Search System处决西海岸DOCAWolfsberg锂项目确定可行性研究结果
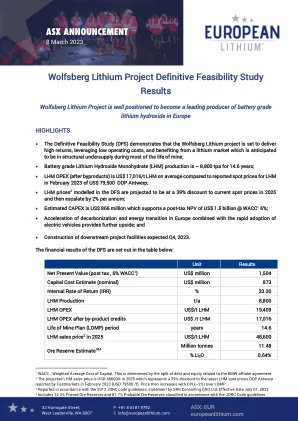
Wolfsberg项目是通过欧洲锂的100%拥有的子公司GmbH的欧洲锂进行的。欧洲锂的目的是成为欧洲最大的当地关键盐氢氧化锂一水合物(LHM)的本地供应商。托尼·萨奇(Tony Sage)主席,对DFS结果评论:“ DRA提供的强大DFS对沃尔夫斯伯格项目的商业化充满信心。这个积极的消息是在锂的浮力市场中出现的,并且果断行动的紧迫性加速了加速绿色能源过渡,尤其是在欧洲。我们的下一步包括最终确定纳斯达克关键金属的清单,并继续与金融家进行讨论。通过与Sizzle的业务结合,重要的金属公司希望获得美国市场可用的大量机会。”在2018年4月的Wolfsberg项目完成前可行性研究(PFS)的基础上,该公司进行了广泛的填充地质钻探,矿物加工和冶金测试工作,建立了一项试验性测试设施,生产了1.7 t的Spodumene浓缩液,更新了其营销研究,并完成了其营销研究,并完成了整个环境的测试。这项工作的结果已经流入了Wolfsberg DFS中,该DFS对Wolfsberg Project的引人入胜的经济学进行了准确,详细的分析。Wolfsberg DFS计划平均(稳态)矿山生产率为780 kt/a,在我的寿命(LOM)上达到840 kt/a的峰值,该矿井(LOM)基于11.5吨的矿石储备,在大约15年内开采。The DFS has been prepared to international standards with Mineral Resource and Ore Reserve estimates prepared in accordance with the Australasian Code for Reporting of Exploration Results, Mineral Resources and Ore Reserves (the JORC Code, 2012 ) guidelines, as published by the Joint Ore Reserves Committee of the Australasian Institute of Mining and Metallurgy, Australian Institute of Geoscientists and Minerals Council of Australia.该项目将包括两个集成的操作,一个采矿和加工操作,以生产锂浓缩液(Spodumene)和一个水透析植物,以将Spodumene转换为电池级LHM。计划在LOM上产生约8.8 kt/a LHM,总产生约129 kt的LHM。LHM的预测定价假设是基于2025年欧洲当前现货价格(〜48 600/t)的39%折扣,然后从2026年开始随着美国消费者价格指数(CPI)的升级(请参阅第9.6段)。针对动植物的现场调查已在计划中的矿场和集中剂地点完成。DFS证明,电池电动汽车(BEV)的采矿机队在沃尔夫斯伯格项目上可以经济可行。该研究证实,地下门户,集中器和所有所需的表面基础设施可以位于小于10公顷的区域内,这大大降低了Wolfsberg Project的环境足迹。欧洲锂致力于其Wolfsberg项目的可持续发展,利用最先进的采矿和加工技术成为LHM的可靠低碳生产商,并成为欧洲新兴锂供应链的关键部分。
2024 年第四季度业绩
本演示文稿包含美国 1995 年私人证券诉讼改革法案所定义的前瞻性陈述,通常可通过诸如“潜在”、“预期”、“将”、“计划”、“渠道”、“展望”、“有信心”等词语或类似表达来识别,或通过关于潜在新产品、现有产品的潜在新适应症、潜在产品发布或任何此类产品的潜在未来收入的明示或暗示讨论来识别;或关于正在进行的临床试验的结果;或关于潜在的未来、待定或已宣布的交易;关于潜在的未来销售或收益;或通过战略、计划、期望或意图的讨论,包括关于我们继续投资于新的研发能力和制造的讨论;或关于我们的资本结构。此类前瞻性陈述基于管理层对未来事件的当前信念和期望,并受重大已知和未知风险和不确定性的影响。如果这些风险或不确定性中的一个或多个成为现实,或者基本假设被证明不正确,实际结果可能与前瞻性陈述中的结果大不相同。您不应过分依赖这些陈述。无法保证本演示文稿中描述的试验性或已获批准产品将在任何市场或任何特定时间提交或获准销售或用于任何其他适应症或标签。也无法保证此类产品将来会取得商业上的成功。也无法保证本演示文稿中描述的交易的预期收益或协同效应将在预期的时间内实现,或者根本无法实现。具体而言,我们的预期可能受到以下因素影响:全球医疗成本控制的不确定性,包括持续的政府、付款人和公众定价和报销压力以及提高定价透明度的要求;主要产品成功、商业优先事项和战略的不确定性;新产品研发的不确定性,包括临床试验结果和对现有临床数据的额外分析;我们获得或维持专有知识产权保护的能力,包括失去主要产品的专利保护和独占权对诺华的最终影响程度;我们能否实现外部业务机会所预期的战略利益、运营效率或机遇存在不确定性;在开发或采用可能带来变革的数字技术(包括人工智能)方面存在不确定性,和商业模式;围绕我们新 IT 项目和系统实施的不确定性;关于潜在重大信息安全漏洞或我们信息技术系统中断的不确定性;关于实际或潜在法律诉讼的不确定性,包括与本演示文稿中描述的产品和管道产品相关的监管行动或延迟或政府监管;安全、质量、数据完整性或制造问题;我们在环境、社会和治理措施和要求方面的表现和遵守能力;重大地缘和社会政治发展,包括战争对世界某些地区的影响;关于未来全球汇率的不确定性;关于我们产品未来需求的不确定性;以及诺华公司最近提交的 20-F 表以及随后提交给美国证券交易委员会的报告中提及的其他风险和因素。诺华在本演示文稿中提供的信息截至目前,并不承担因新信息、未来事件或其他原因而更新任何前瞻性陈述的义务。
Blueprint Medicines 宣布 BLU-945 概念验证数据支持启动综合联合治疗
-- Blueprint Medicines 将于美国东部时间 4 月 8 日星期五下午 2:00 举行投资者电话会议和网络直播 -- 马萨诸塞州剑桥,2022 年 4 月 8 日 -- Blueprint Medicines Corporation (NASDAQ: BPMC) 今天公布了 BLU-945 1/2 期 SYMPHONY 临床试验的概念验证数据,BLU-945 是一种针对晚期 EGFR 突变型非小细胞肺癌 (NSCLC) 的试验性精准疗法。试验结果显示,安全性和临床活性的早期证据与临床前数据一致,支持扩大 BLU-945 与包括奥希替尼在内的多种药物联合使用的开发计划,目的是预防或治疗肿瘤耐药性,延长患者受益时间。这些数据今天在新奥尔良举行的 2022 年美国癌症研究协会 (AACR) 年会上公布。 SYMPHONY 试验正在进行的 I 期剂量递增部分的早期数据显示,循环肿瘤 DNA(EGFR 变异等位基因分数)和放射学肿瘤缩小呈剂量依赖性减少,包括以 400 mg 每日一次 (QD) 治疗的患者的部分缓解 (PR),这是截至数据截止日期测试的最高剂量。药代动力学结果显示,较高剂量的 BLU-945 暴露与广泛的 EGFR 突变覆盖相关,包括激活的 L858R 突变,无论是否有奥希替尼耐药的 C797S 突变。BLU-945 通常耐受性良好,没有与野生型 EGFR 抑制相关的重大不良事件 (AE)。最大耐受剂量和推荐的 II 期剂量尚未确定,剂量递增仍在继续。“今天,靶向疗法是 EGFR 突变肺癌的主要治疗方法,但大多数患者出现肿瘤耐药性,导致突变异质性和疾病进展。迫切需要创新的治疗策略,包括靶向治疗组合,来预防或治疗这种突变异质性并延长患者受益,”纽约大学朗格尼医学中心珀尔马特癌症中心医学系助理教授兼肿瘤内科医生、SYMPHONY 试验研究员 Elaine Shum 医学博士说道。“今天报告的 BLU-945 初步数据凸显了其有望解决对奥希替尼等当前标准疗法的耐药性,并能够实现耐受性良好、作用广泛的组合,这是改善 EGFR 突变型肺癌患者预后的重要一步。”“我们认为 BLU-945 与其他 EGFR 靶向疗法的不同之处在于,它能够抑制最难靶向的 EGFR 突变,同时保持比野生型 EGFR(已知的毒性驱动因素)更宽的治疗指数。因此,BLU-945 作为与其他靶向疗法和广谱药物的联合用药具有巨大潜力,”Blueprint Medicines 研发总裁 Fouad Namouni 医学博士表示。“我们很高兴看到 BLU-945 的临床前特性在临床中得到转化,早期剂量递增数据显示了临床活性、广泛的 EGFR 突变覆盖率和耐受性。基于这些有希望的数据,我们计划迅速扩大 BLU-945 的开发
新闻稿
美国首个也是唯一一个 CLDN18.2 靶向疗法 东京,2024 年 5 月 30 日——安斯泰来制药公司(TSE:4503,总裁兼首席执行官:Naoki Okamura,“安斯泰来”)今天宣布,美国食品药品监督管理局 (FDA) 已承认该公司重新提交了 zolbetuximab 的生物制品许可申请 (BLA),zolbetuximab 是一种一流的试验性 claudin (CLDN) 18.2 靶向单克隆抗体,用于一线治疗局部晚期不可切除或转移性人表皮生长因子受体 2 (HER2) 阴性胃或胃食管连接处 (GEJ) 腺癌的成人患者,其肿瘤为 CLDN18.2 阳性。一旦获得批准,zolbetuximab 将成为美国批准针对该患者群体的首个 CLDN18.2 靶向治疗药物 根据处方药使用者付费法案 (PDUFA),FDA 设定了新的目标行动日期为 2024 年 11 月 9 日。 在美国,据估计,2024 年将有 26,890 人被诊断出患有胃癌,10,880 人将死于该疾病。1 由于早期胃癌症状经常与更常见的胃相关疾病重叠,因此胃癌通常在晚期或转移性阶段被诊断出来,或者在胃癌从肿瘤来源扩散到其他身体组织或器官后才被诊断出来。2 转移性患者的五年相对生存率为 7%。1 Moitreyee Chatterjee-Kishore,博士,工商管理硕士,安斯泰来高级副总裁兼免疫肿瘤学开发主管 “安斯泰来致力于为难治性癌症推出新的靶向疗法。晚期胃癌或 GEJ 癌患者通常面临着巨大的未满足需求,FDA 对 zolbetuximab BLA 重新提交的认可,使我们距离为美国面临这种致命疾病的合格患者提供这一重要治疗选择又近了一步。” zolbetuximab BLA 于 2024 年 5 月 9 日重新提交,此前 FDA 于 2024 年 1 月 4 日因在设施许可前检查中发现第三方制造缺陷而发出了完整回复信。FDA 未对 zolbetuximab 的临床数据(包括疗效或安全性)提出任何担忧,也未要求进行额外的临床研究来支持 BLA 批准。zolbetuximab BLA 基于 3 期 SPOTLIGHT 和 GLOW 临床试验的结果。 3,4 SPOTLIGHT 研究评估了佐贝妥昔单抗加 mFOLFOX6(一种包括奥沙利铂、亚叶酸钙和氟尿嘧啶的联合方案)与安慰剂加 mFOLFOX6 的疗效。GLOW 研究评估了佐贝妥昔单抗加 CAPOX(一种包括卡培他滨和奥沙利铂的联合化疗方案)与安慰剂加 CAPOX 的疗效。
q3-2024-投资者介绍.pdf
本报告包含美国 1995 年私人证券诉讼改革法案所定义的前瞻性陈述,通常可通过诸如“潜在”、“预期”、“将”、“计划”、“管道”、“展望”、“自信”等词语或类似表达来识别,或通过关于潜在新产品、现有产品的潜在新适应症、潜在产品发布或任何此类产品的潜在未来收入的明示或暗示讨论来识别;或关于正在进行的临床试验的结果;或关于潜在的未来、待定或已宣布的交易;关于潜在的未来销售或收益;或通过战略、计划、期望或意图的讨论,包括关于我们继续投资于新的研发能力和制造的讨论;或关于我们的资本结构;或关于 Sandoz 拆分和我们转变为“纯粹”创新药物公司的后果。此类前瞻性陈述基于管理层对未来事件的当前信念和期望,并受重大已知和未知风险和不确定性的影响。如果这些风险或不确定因素中的一个或多个成为现实,或基本假设被证明不正确,实际结果可能与前瞻性陈述中的结果存在重大差异。您不应过分依赖这些陈述。无法保证本新闻稿中描述的试验性或已批准产品将在任何市场或任何特定时间提交或批准销售或获得任何其他适应症或标签。也不能保证此类产品未来会取得商业上的成功。也不能保证本新闻稿中描述的交易的预期收益或协同效应将在预期的时间内实现,或者根本无法实现。特别是,我们的预期可能受到以下因素的影响:关于关键产品成功、商业优先事项和战略的不确定性;新产品研发的不确定性,包括临床试验结果和对现有临床数据的进一步分析;关于使用新的颠覆性技术(包括人工智能)的不确定性;全球医疗成本控制趋势,包括持续的政府、付款人和公众定价和报销压力以及提高定价透明度的要求;我们能否实现外部业务机会所预期的战略利益、运营效率或机会的不确定性;我们能否实现将 Sandoz 分离为一家新的独立上市公司所预期的利益;我们能否获得或维持专有知识产权保护,包括失去关键产品的专利保护和独占权对诺华的最终影响程度;潜在变革性数字技术和商业模式的开发或采用方面的不确定性;围绕我们新 IT 项目和系统实施的不确定性;关于潜在重大信息安全漏洞或我们信息技术系统中断的不确定性;关于实际或潜在法律诉讼的不确定性,包括与本新闻稿中描述的产品和管道产品有关的监管行动或延迟或政府监管;安全、质量、数据完整性或制造问题;我们在环境、社会和治理措施和要求方面的表现和遵守能力;重大政治、宏观经济和商业发展,包括战争对世界某些地区的影响;关于未来全球汇率的不确定性;关于我们产品未来需求的不确定性;以及诺华公司最近提交的 20-F 表以及随后向美国证券交易委员会提交或提供的报告中提及的其他风险和因素。诺华在本演示文稿中提供截至目前的信息,并不承担因新信息、未来事件或其他原因更新任何前瞻性陈述的义务。
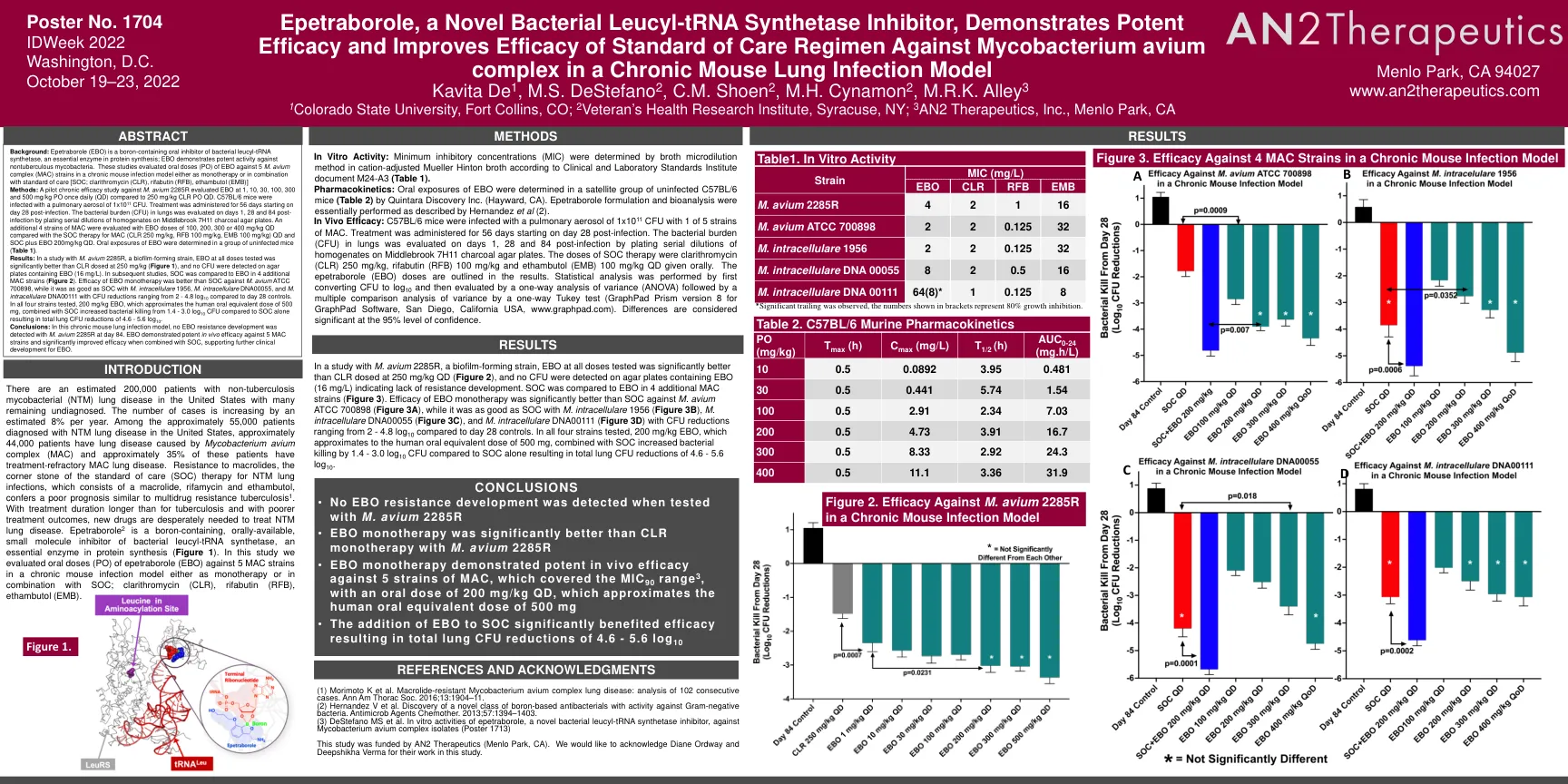
Epetraborole是一种新型的细菌亮氨基-TRNA合成酶抑制剂,它表现出有效的功效并提高了护理标准方案的功效
背景:Epetraborole(EBO)是含硼的口服叶木基-TRNA合成酶的口服抑制剂,这是蛋白质合成中必不可少的酶; EBO表现出对非结核分枝杆菌的有效活性。这些研究评估了EBO的口服剂量(PO)针对慢性小鼠感染模型中的5 M. Avium复合物(MAC)菌株作为单一疗法或与标准护理[SOC;克拉霉素(CLR),利法布丁(RFB),ethambutol(emb)]方法:针对Avium 2285R M. 2285r评估EBO的试验性慢性疗效研究,每天1、10、30、100、300和500 mg/kg PO每天(QD)(QD),而不是250 mg/kg/kg Clr PO QD。C57BL/6小鼠用1x10 11 CFU的肺气溶胶感染。从感染后第28天开始进行56天的治疗。在感染后第1、28和84天评估肺中的细菌负担(CFU),通过在Middlebrook 7H11木炭琼脂板上镀匀性稀释液。与MAC的SOC治疗(CLR 250 mg/kg,RFB 100 mg/kg,100 mg/kg),EBO剂量为100、200、300或400 mg/kg QD评估了4株Mac菌株。在一组未感染的小鼠中确定了EBO的口服暴露(表1)。 结果:在对Avium 2285R的一项研究中,生物膜形成菌株,EBO在所有剂量上测试的EBO明显好于以250 mg/kg剂量的CLR(图1),并且在含有EBO的琼脂平板上检测到NO NO CFU(16 mg/L)。 在随后的研究中,将SOC与其他4种MAC菌株中的EBO进行了比较(图2)。 结论:在这种慢性小鼠肺部感染模型中,在第84天未检测到Avium 2285R的EBO耐药性发展。在一组未感染的小鼠中确定了EBO的口服暴露(表1)。结果:在对Avium 2285R的一项研究中,生物膜形成菌株,EBO在所有剂量上测试的EBO明显好于以250 mg/kg剂量的CLR(图1),并且在含有EBO的琼脂平板上检测到NO NO CFU(16 mg/L)。在随后的研究中,将SOC与其他4种MAC菌株中的EBO进行了比较(图2)。结论:在这种慢性小鼠肺部感染模型中,在第84天未检测到Avium 2285R的EBO耐药性发展。EBO单一疗法的功效比SOC比对Avium ATCC 700898更好,而与M. Intacellulare 1956,M。el. ellacelulare DNA00055和M. el. ellacululare DNA00111相比,与2-4.8 log 10相比,它与M. Intarululare DNA00055和M. M. soc一样好。在测试的所有四种菌株中,200 mg/kg EBO近似于500 mg的人口腔等效剂量,与单独使用SOC相比,SOC的细菌杀死从1.4-3.0 log 10 CFU增加,从而导致总肺CFU降低总量为4.6-5.6 log 10。eBO与5种MAC菌株具有有效的体内功效,并在与SOC结合使用时会显着提高功效,从而支持EBO的进一步临床发育。
STAC-BBB ELT 更新
本演示文稿及其随附的口头评论包含有关我们当前期望的前瞻性陈述。这些前瞻性陈述包括但不限于与下列事项有关的陈述:我们候选产品和工程衣壳的治疗和商业潜力,包括 STAC TM -BBB 释放治疗各种神经系统疾病的巨大潜力的能力,我们专注于表观遗传调控和衣壳工程的计划,开发、获得监管部门批准和商业化治疗某些疾病的持久、安全、有效疗法的潜力以及此类疗法的时机、可用性和成本,使用 ZF、MINT 平台、SIFTER 和其他技术开发持久、安全、有效的疗法和衣壳的潜力,我们从合作中受益并赚取前期费用、开发和商业里程碑和特许权使用费的潜力以及任何此类收益和付款的时机,基因泰克完成临床开发、监管互动、制造和任何由此产生的产品的全球商业化的潜力,辉瑞对 giroctocogene fitelparvovec 计划的持续推进,包括辉瑞完成临床开发、监管互动、制造和任何由此产生的产品的全球商业化的潜力,现有和新的合作及其时间安排、为某些项目寻找合作伙伴或合作者的计划和期望、有关我们财务资源的计划(包括其充足性)以及降低运营费用的计划、我们精简结构的影响和未来潜在的成本削减、我们和我们的合作者进行我们正在进行的和潜在的未来临床试验的预期计划和时间表以及展示我们和我们合作伙伴的临床试验数据和提交监管申请、我们产品候选物的预期进展到后期开发,包括潜在的未来注册试验、我们公司战略的执行、我们的产品线、额外目标的确定以及临床前项目向临床的进展、关键里程碑和催化剂以及其他非历史事实的陈述。这些陈述并非对未来业绩的保证,并且受某些难以预测的风险和不确定性的影响。我们的实际结果可能与所表达的结果存在重大不利差异。可能导致实际结果不同的因素包括但不限于不确定且昂贵的研发过程,包括临床前结果可能无法预示未来临床试验的风险、与宏观经济因素相关的风险和不确定性,包括持续的海外冲突造成的风险,银行倒闭导致银行存款和贷款承诺中断,对全球商业环境、医疗保健系统以及我们和我们合作者的业务和运营造成影响,包括临床试验的启动和运行;研究和开发过程;临床试验时间的不确定性和结果的不可预测性,包括初步或初始临床试验数据是否代表最终临床试验数据,以及最终临床试验数据是否验证候选产品的安全性、有效性和耐用性;临床试验延迟、暂停和搁置对临床试验时间表和候选产品商业化的影响;多个监管机构对候选产品的不可预测的监管审批流程;产品、候选产品和衣壳的制造;已获批准产品的商业化;技术发展可能取代我们和我们的合作者所使用的技术;我们或我们的合作者违反或终止合作协议的可能性;我们可能无法实现合作的预期收益;我们未来资本需求、财务表现和业绩的不确定性,我们缺乏资本资源来充分开发、获得监管部门批准和商业化我们的产品候选物,包括我们确保某些项目合作的能力、我们确保推进临床前项目所需资金的能力和/或及时或完全启动 isaralgagene civaparvovec 的潜在注册试验;以及我们需要大量额外资金来执行我们的运营计划和持续经营,包括我们无法获得推进临床前和临床项目所需资金的风险以及无法持续经营,在这种情况下,我们可能需要完全停止运营、清算全部或部分资产和/或根据适用的破产法寻求保护。我们和我们的合作者无法保证能够开发出具有商业价值的产品。这些风险和不确定性在我们截至 2023 年 12 月 31 日财年的 10-K 表年度报告中有更详细的描述,并由 Sangamo 提交给美国证券交易委员会 (SEC) 的截至 2024 年 3 月 31 日和 2024 年 6 月 30 日的季度 10-Q 表季度报告和未来提交给 SEC 的报告中进行了补充。本演示文稿中包含的前瞻性陈述仅代表截至本演示文稿之日的观点,除适用法律要求外,我们不承担更新此类信息的义务。本演示文稿涉及正在进行临床前和/或临床研究且尚未获得任何监管机构批准上市的试验性产品候选物。目前,这些药物仅供研究使用,且未就其安全性或有效性做出任何陈述,以用于研究目的。任何关于安全性或有效性的讨论仅针对此处提供的具体结果,并不代表监管机构最终认定的安全性或有效性。