XiaoMi-AI文件搜索系统
World File Search System钠-葡萄糖协同转运蛋白 2 抑制剂的利用和...
钠-葡萄糖协同转运蛋白 2 (SGLT2) 抑制剂是一种具有保护心脏和肾脏功能的抗糖尿病药物。此外,它还能防止肾小管部分的钠吸收并降低肾脏的肾小球内压力。最近,无论慢性肾病患者是否患有糖尿病,SGLT 抑制剂的使用都在增加。然而,有关 SGLT2 抑制剂使用的全球数据仍然有限。我们对肾脏病诊所使用 SGLT2 抑制剂的慢性肾病患者进行了一项描述性研究。 2017 年至 2022 年期间,共有 156 名患者被处方 SGLT2 抑制剂。其中,58.3% 为男性,平均年龄为 61 ± 13 岁,86.5% 患有糖尿病,平均估计肾小球滤过率 (eGFR) 为 46.41 ± 21.14 ml/min/1.73m 2,蛋白尿为 2.22 ± 2.62 g/天。总共有 85.9% 的患者同时使用肾素血管紧张素系统 (RAS) 阻滞剂,而大多数未使用 RAS 阻滞剂的患者为 4 期慢性肾脏病患者。在非糖尿病患者中,81% 患有肾小球肾炎,其中一半为 IgA 肾病,42.9% 的患者正在使用免疫抑制剂。使用 SGLT2 抑制剂 6 个月内 eGFR 下降速度显著降低,从 -3.46 + 6.56 ml/min/1.73m 2 降至 -0.77 + 7.97 ml/min/1.73m 2 (p=0.001)。此外,eGFR下降速度的显著抑制也体现在
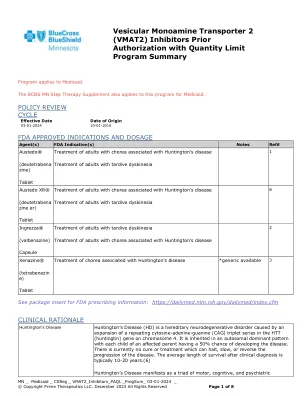
囊泡单胺转运蛋白2(VMAT2)抑制剂先验授权,具有数量限制程序摘要
多年来逐渐开始并进展的疾病。这些HD的疾病不能与一个领域的残疾孤立考虑,导致另一个领域的问题。认知障碍的特征是降低了心理处理的速度和灵活性。精神疾病较不可预测。人们可能患有抑郁症,躁狂症,强迫症和各种形式的精神病。几乎所有具有高清的人都会经历特定疾病的人格和行为变化,从而对其婚姻,社会和经济福祉造成严重影响。运动障碍包括非自愿运动(唱片)的出现以及自愿运动的损害,从而导致手动敏捷性降低,言语含糊,吞咽困难,平衡问题和跌倒。最公认的运动症状是骗子,传统上,亨廷顿氏病的临床诊断是基于对此症状的观察。超过90%受HD影响的人患有唱片,其特征是非自愿运动通常是突然,不规则且毫无目的的运动。在疾病早期的肢体中,运动通常更为突出,但最终可能包括随着疾病的进展,面部鬼脸,眼睑抬高,颈部,肩膀,肩膀,躯干和腿部运动。绒毛膜通常会随着时间的流逝而增加频率和振幅,并且可能在疾病发作后大约10年达到峰值。(6)治疗绒毛膜是高清管理的重要组成部分,如果绒毛膜引起患者的困扰或不适,则应考虑。(1-3,8)囊泡单胺转运蛋白2(VMAT 2)抑制剂是FDA标记的治疗剂,除非患者患有管理良好的抑郁症或自杀思想,否则被认为是一线治疗。(4)确切的作用机理尚不清楚,但是VMAT2抑制剂被认为可以作为单胺(例如多巴胺,羟色胺,去甲肾上腺素和组胺)的可逆消耗施加其抗凝血作用。它们可逆地抑制VMAT2,这是一种调节单胺从细胞质摄取到突触囊泡的转运蛋白,导致单胺摄取减少和单胺储存的耗竭。
新型多巴胺转运蛋白抑制剂CE-123和Modafinil的药代动力学,重点是中枢神经系统分布
1,维也纳大学的药学系,奥地利维也纳1090; iva.spreitzer@univie.ac.at(I.S.); thierry.langer@univie.ac.at(T.L.)2维也纳医学院,营养和体育科学学院,维也纳大学,奥地利维也纳1090年3月3日转化药代动力学/药物动力学小组,乌普萨拉大学药学系,75123 UPPSALA,瑞普萨拉,瑞典4年4月4日,蛋白质组织,帕纳西尔大学,5020, gert.lubec@lubeclab.com(G.L.)5能力单元分子诊断,中心健康和生物库,AIT奥地利理工学院GmbH,奥地利维也纳1210; winfried.neuhaus@ait.ac.at 6医学院医学和牙科学院,多瑙河私立大学,奥地利Krems 3500); irena.loryan@farmaci.uu.se(i.l.)
使用钠 - 葡萄糖转运蛋白2抑制剂成功治疗Nivolumab和ipilimumab触发了1型糖尿病:病例报告和系统评价
在1型糖尿病中,除了胰岛素治疗外,还建议使用钠 - 葡萄糖转运蛋白(SGLT)2抑制剂作为日本的另一种疗法。最近对1型糖尿病(描述)临床试验患者进行的Dapagliflozin评估表明,使用Dapagliflozin在1型糖尿病患者受胰岛素不足控制的患者中具有有益的作用(14,15)。2019年,日本卫生部,劳动和福利部批准了Dapagliflozin作为1型糖尿病患者胰岛素的口服辅助治疗。SGLT2抑制剂患酮酸酸性病的风险较低,但风险被认为高于其他抗糖尿病药物的风险(16,17)。由于酮症酸中毒可能出现CPI触发的糖尿病,因此SGLT2抑制剂不被视为治疗选择,胰岛素治疗是主要治疗方法。但是,由于1型糖尿病和CPI触发的糖尿病都是胰岛素缺陷疾病,因此在胰岛素治疗之上添加SGLT2抑制剂,如果谨慎使用CPI触发的糖尿病,则可以在CPI触发的糖尿病中提供更好的血糖控制。
非典型多巴胺转运蛋白抑制剂CE-158在雄性大鼠的前额叶皮层中增强了多巴胺神经传递:一种行为,电prophy
非典型多巴胺转运蛋白抑制剂S,s立体异构体为5-((((s) - (((S) - ((3-溴苯基)(3-苯基)甲基)甲基磺基)甲基甲基)甲基苯二唑(CE-158),最近由我们的实验室进行了促进和行为效果,已被我们的实验室施加了效果,并促进了我们的实验室的作用。然而,基于通过多巴胺转运蛋白抑制增强多巴胺神经传递的增强,对与CE-158的慢性治疗相关的关键特征(以及可能的副作用)对治疗策略至关重要。的确,心理刺激因素因其亲精神分子的序列或虐待责任而被广泛认可,因此不适合临床批准。我们在这里提出对以不同剂量用CE-158进行重新施用的成年雄性大鼠进行的调查。在我们的条件下,CE-158没有证据表明诱发精神病症状或虐待责任,从而证实了其前额叶相关的亲活动效力。我们的发现支持CE-158作为治疗病理状况的有前途的药物的安全性,例如注意力缺陷多动障碍或痴呆,其特征是前额叶多巴胺神经传递改变。
肾脏药物转运蛋白OAT1对肠道微生物组组成和尿酸脑稳态
引言有机阴离子转运蛋白1(OAT1/SLC22A6)的功能被认为是许多小带负电荷有机分子从血液中移动到尿液中的速率限制步骤(1)。是原始的SLC和ABC药物转运蛋白之一,该转运蛋白被FDA突出显示用于测试与新药物实体的相互作用(1-3)。这是由于其在排泄许多药物(例如抗生素,抗病毒药,NSAID,利尿剂)中的作用(2,4,5)。最近的研究发现了其在调节系统性和肾脏代谢以及信号传导中涉及的内源性途径中的关键作用。在小鼠模型中使用体外传输数据和OAT1的体内KO已被用于识别该转运蛋白处理的内源代谢产物。这些研究(6-9)表明,OAT1 -KO小鼠中的许多代谢产物源自肠道微生物。OAT1以及其他SLC和ABC“药物”转运蛋白(例如OATP1B1,MRP2,ABCG2)被认为是由> 500蛋白组成的拟议遥感和信号网络中的关键系统和器官中心(2,10,11)。遥感和信号传导理论(RSST)认为,这种基因网络部分与调节药物吸收,分布,代谢和排泄的基因重叠(ADME),可维持体内众多内源性小分子的体内平衡(2,12,12,13,13)。当慢性肾脏疾病期间肾功能降低时,在人体病理生理中作用中遥感和信号系统的一个例子(12)。当肾脏不再能够有效地处理尿酸盐时,嘌呤代谢和抗氧化剂的常见终端产生会导致尿酸盐的积累会导致痛风,高血压和肾脏和心血管疾病的进展(14)。结果,肠道改变了ABCG2的表达和/或功能,并部分远程补偿受损的肾脏,从而通过将其排泄到肠道中来消除血液(15)。
经皮后冠状动脉干预(PCI)钠 - 葡萄糖共转运蛋白-2(SGLT2)抑制剂诱导的Euglycemic Di
euglycemic糖尿病性酮症酸中毒(DKA)是一种罕见但在临床上很重要的表现,可以导致糖尿病患者的发病率和死亡率显着。它与多种病因相关,包括葡萄糖共晶2(SGLT2)抑制剂的使用。此病例报告详细介绍了一名28岁男性患者的介绍,该患者最近被诊断出患有心肌梗死(NSTEMI)状态后,冠状动脉干预后(PCI)左右前降(LAD)和2型糖尿病(LAD)和2型糖尿病(T2DM)(T2DM)(T2DM)(T2DM)(T2DM)(T2DM),并在新的医疗方案上排出了SGIND 2,并在新的医疗方案上排出。五天后患者出现呼吸困难,恶心和呕吐。在初步评估时,他患有心动过速和高血压。实验室的工作显示高钾血症,代谢阴离子酸中毒以及尿液中酮和葡萄糖的存在,从而诊断出尤古血糖DKA。该患者是静脉内(IV)胰岛素,碳酸氢盐和D5½正常盐水(NS)的开始,需要连续五天治疗阴离子间隙才能闭合。
肌酸转运蛋白缺乏症患者的人脑器官的神经元缺损和蛋白质谱变化
1巴黎 - 萨克莱大学,CEA,INRAE,卫生药品和技术系,法国Gif Sur Yvette; 2阿拉伯联合酋长国沙迦大学药学院药学和药物治疗系; 3阿拉伯联合酋长国沙迦大学沙迦医学研究所; 4个Ceres Brain Therapeutics,法国巴黎; 5 ELKH自然科学研究中心酶学研究所和匈牙利布达佩斯塞梅尔维斯大学的分子医学学院; 6美国辛辛那提儿童研究基金会辛辛那提大学医学院和神经病学系儿科学系; 7 Supbiotech/祈祷和非典型感染的研究服务(SEPIA),法国巴黎萨克莱大学CEA弗朗索瓦·雅各布研究所; 8巴黎 - 萨克莱大学,CEA,INRAE,卫生药品和技术系(DMTS),SPI,Bagnols-Sur-Cèze,法国; 9阿拉伯联合酋长国沙迦大学医学院临床科学系;英国伦敦伦敦大学学院外科与介入科学系10分部;1巴黎 - 萨克莱大学,CEA,INRAE,卫生药品和技术系,法国Gif Sur Yvette; 2阿拉伯联合酋长国沙迦大学药学院药学和药物治疗系; 3阿拉伯联合酋长国沙迦大学沙迦医学研究所; 4个Ceres Brain Therapeutics,法国巴黎; 5 ELKH自然科学研究中心酶学研究所和匈牙利布达佩斯塞梅尔维斯大学的分子医学学院; 6美国辛辛那提儿童研究基金会辛辛那提大学医学院和神经病学系儿科学系; 7 Supbiotech/祈祷和非典型感染的研究服务(SEPIA),法国巴黎萨克莱大学CEA弗朗索瓦·雅各布研究所; 8巴黎 - 萨克莱大学,CEA,INRAE,卫生药品和技术系(DMTS),SPI,Bagnols-Sur-Cèze,法国; 9阿拉伯联合酋长国沙迦大学医学院临床科学系;英国伦敦伦敦大学学院外科与介入科学系10分部;
通过蛋白质转运偶联靶向蛋白质重新定位
标题:通过蛋白质传输耦合作者靶向蛋白质迁移:Christine S. C. Ng,1 Aofei Liu,1 Bianxiao Cui,1 Steven M. Banik 1,2 * 1化学系,斯坦福大学,斯坦福大学,斯坦福大学,加利福尼亚州斯坦福大学,加利福尼亚州94305,美国。2 Sarafan Chem-H,斯坦福大学,加利福尼亚州斯坦福大学94305,美国。 *通讯作者。 电子邮件:sbanik@stanford.edu摘要亚细胞蛋白定位调节蛋白质功能,并且可以在癌症1和神经退行性疾病中损坏2-4。 已经注释了许多蛋白质的定位5-7,并且在药理学上相关的方法来精确重新定位以解决疾病驱动表型,这将是一种有吸引力的目标治疗方法。 分子利用班车蛋白的运输来控制靶蛋白的亚细胞定位,可以为靶向蛋白质重新定位提供相互作用的培养基疗法的途径。 为了实现这一概念,我们采用了一种定量方法来识别控制劫持蛋白质运输能力,开发梭子蛋白和配体的收集能力的特征,并证明了具有内源性定位信号的蛋白质的重新定位。 使用自定义成像分析管道,我们表明,可以通过将靶蛋白与含有足够强的本地本地定位序列的靶蛋白进行分子偶联来克服内源性定位信号。 小分子介导的FUS R495X从细胞质中固定在细胞核中,在细胞应激模型中减少了细胞应激颗粒的数量。 简介2 Sarafan Chem-H,斯坦福大学,加利福尼亚州斯坦福大学94305,美国。*通讯作者。电子邮件:sbanik@stanford.edu摘要亚细胞蛋白定位调节蛋白质功能,并且可以在癌症1和神经退行性疾病中损坏2-4。已经注释了许多蛋白质的定位5-7,并且在药理学上相关的方法来精确重新定位以解决疾病驱动表型,这将是一种有吸引力的目标治疗方法。分子利用班车蛋白的运输来控制靶蛋白的亚细胞定位,可以为靶向蛋白质重新定位提供相互作用的培养基疗法的途径。为了实现这一概念,我们采用了一种定量方法来识别控制劫持蛋白质运输能力,开发梭子蛋白和配体的收集能力的特征,并证明了具有内源性定位信号的蛋白质的重新定位。使用自定义成像分析管道,我们表明,可以通过将靶蛋白与含有足够强的本地本地定位序列的靶蛋白进行分子偶联来克服内源性定位信号。小分子介导的FUS R495X从细胞质中固定在细胞核中,在细胞应激模型中减少了细胞应激颗粒的数量。简介我们将核激素受体作为可行的班车发展,可以用靶向固定化激活分子(TRAM)来利用,以重新分布驱动疾病的突变蛋白,例如SMARCB1 Q318X,TDP43 D NLS和FUS R495X。使用CAS9介导的敲入标签,我们证明了低丰度(FOXO3A)和高丰度(FKBP12)内源性蛋白质的核富集通过分子偶联到核激素受体运输。最后,在原代神经元中,小分子介导的NMNAT1从核向轴突重新分布能够减慢轴突变性,并在药理学上模仿WLDS从小鼠到某些类型的NeuroDegeneration 8。因此,靶向蛋白质重新定位的概念可以通过相互作用重新布线来治疗疾病的方法。
解锁转运蛋白以促进药物研发
摘要 溶质载体 (SLC) 膜转运蛋白包含一个易于处理但尚未得到充分研究的靶标家族,可用于潜在的药物干预。最近对人类遗传与疾病的关联分析,结合诸如寻找合成致死性等介入方法,揭示了各种 SLC 家族成员与未满足治疗需求的疾病之间的新联系。荧光成像板读取器 (FLIPRTM,Molecular Devices) 与响应细胞膜电位 (MP) 的荧光染料相结合,为进行 SLC 指导的药物发现提供了一个多功能平台。这是因为许多 SLC 运输带电溶质或溶质与离子结合,因此易位与 MP 的变化有关。我们展示了两次完整的高通量筛选 (HTS) 活动的结果,以说明该平台的应用。SLC 通过杆状病毒介导的转导在粘附的 U2OS 宿主细胞中表达。将染料加载到 1536 孔高密度微量滴定板中的细胞,与测试药物预孵育,并用底物(氨基酸或糖)进行攻击。通过与对未转化宿主细胞的 KCl 诱发的 MP 反应的影响进行比较,筛选出具有非 SLC 特异性作用的药物。从大约 200 万种化合物的完整筛选集合中,对 500-2000 种推定的抑制剂进行了研究,以确定对密切相关转运蛋白的特异性(也使用 FLIPR),并通过非 FLIPR 方法证实真实的 SLC 抑制(即“正交性”)。HTS 活动在有吸引力的化学空间中提供了新的化学起点,从而能够探索结构-活性关系 (SAR),并有助于在动物模型中确认每种情况下的治疗假设:药物介导的 SLC 抑制将诱导对疾病有益的生理效应。