XiaoMi-AI文件搜索系统
World File Search System霍奇金淋巴瘤(HL)
g-CSF:预防性粒细胞群刺激因子BeaCOPP:一种化学疗法方案,由博氏霉素(Blenoxane®),依托托糖苷(topasar),阿霉素羟基氯化物(阿霉素)(adrimycin),cycloploploplophamide(cyccroploscin)cinccristancinccristancisticancistccristancisticancisticancisticancisticancistccrist, procarbazine(matulane)和泼尼松ECOG:东部合作肿瘤学组swog:西南肿瘤学组
角蛋白 1 靶向肽-阿霉素结合物在三阴性乳腺癌小鼠模型中的评估
摘要:化疗是三阴性乳腺癌 (TNBC) 的主要治疗方法,TNBC 是一种恶性程度高、预后较差的乳腺癌亚型。虽然化疗药物效果显著,但这些药物缺乏特异性,对癌症和非恶性细胞和组织同样具有毒性。针对 TNBC 的靶向疗法可能会带来更安全、更有效的药物。我们之前设计了一种乳腺癌细胞靶向肽 18-4,它特异性地结合乳腺癌细胞上的细胞表面受体角蛋白 1 (K1)。含有酸敏感腙连接子的肽 18-4 和阿霉素 (Dox) 的缀合物对 TNBC 细胞表现出特定的毒性。在这里,我们报告了在 TNBC 细胞衍生的异种移植小鼠模型中对 K1 靶向肽-Dox 缀合物 (PDC) 的体内评估。与接受 Dox 或生理盐水治疗的小鼠相比,接受该结合物治疗的小鼠的抗肿瘤功效显著提高,脱靶毒性降低。经过六周的治疗后,在第 35 天,与接受 Dox (2.5 mg/kg) 治疗的小鼠相比,接受 PDC (2.5 mg Dox 当量/kg) 治疗的小鼠的肿瘤体积显著缩小 (1.5 倍)。与接受 Dox 治疗的小鼠相比,接受该结合物治疗的小鼠的肿瘤中 Dox 水平显著升高 (1.4 倍),而其他器官中 Dox 水平降低 (1.3-2.2 倍)。15 分钟时采集的血液显示,注射 PDC 的小鼠体内的药物 (PDC 和 Dox) 浓度是注射 Dox 的小鼠体内的药物 (Dox) 浓度的 3.6 倍。研究表明,K1 靶向 PDC 是一种很有前途的治疗 TNBC 的新方法,具有良好的安全性,并且值得进一步研究 K1 靶向结合物作为 TNBC 治疗方法。
阿霉素盐酸盐负载的非离子表面活性剂囊泡治疗转移性和非转移性乳腺癌
摘要:阿霉素盐酸盐(DOX)目前用于治疗正性和转移性乳腺癌。由于其侧面影响,有时在癌症患者中使用DOX。因此,一些科学家尝试设计可以改善药物治疗效率并降低其侧面影响的药物输送系统。在这项研究中,我们设计,制备和生理化学表征的非离子表面活性剂囊泡(NSV)是通过与胆固醇的亲水性(Tween 20)和疏水性(SPAN 20)(SPAN 20)(SPAN 20)(SPAN 20)(SPAN 20)(SPAN 20)和胆固醇的自生组装不同组合获得的。DOX使用被动和pH梯度远程加载程序在NSV中加载,该程序将药物载荷从〜1增加到约45%。NSV,并选择具有最佳生理化学参数的纳米载体,以进一步进行体外测试。NSV稳定,显示出持续的药物释放至72小时。 MCF-7和MDA MB 468细胞的体外研究表明,含有SPAN 20的NSV在MCF-7和MDA MB 468细胞中的内在化更好。nsvs增加了DOX在MCF-7和MDA MB 468细胞中的抗癌效应,并且这种影响是时间和剂量依赖性。使用转移性和非转移性乳腺癌细胞的体外研究还表明,含有SPAN 20的NSV比具有Tween 20的NSV具有更高的细胞毒性。结果数据表明,加载DOX的NSV可能是潜在治疗转移性乳腺癌的有希望的纳米载体。■简介
Siva-1 通过调节胃癌的多药耐药性......
摘要:Siva-1是一种已知的抗凋亡蛋白,在多种癌细胞中发挥作用。然而,Siva-1是否通过NF- κ B通路影响胃癌的多药耐药性目前尚不清楚。本研究旨在确定Siva-1在体外胃癌抗癌药物耐药性中可能的作用。建立了稳定Siva-1过表达的长春新碱(VCR)耐药的KATO III/VCR胃癌细胞系。通过蛋白质印迹法检测Siva-1、NF- κ B、多药耐药1(MDR1)和多药耐药蛋白1(MRP1)的蛋白表达水平。通过测量KATO III/VCR细胞对VCR、5氟尿嘧啶和阿霉素的50%抑制浓度来评估Siva-1过表达对抗癌药物耐药性的影响。流式细胞术检测阿霉素流出率和细胞凋亡率,同时采用集落形成实验、划痕愈合实验和Transwell实验检测细胞增殖、迁移和侵袭。本研究结果显示,Siva-1过表达的KATO III/VCR胃癌细胞对VCR、5氟尿嘧啶和阿霉素的敏感性显著降低。流式细胞术结果显示,Siva-1过表达的KATO III/VCR胃癌细胞对VCR、5氟尿嘧啶和阿霉素的敏感性显著降低。
利用合成细菌孢子进行细胞特异性货物运输
图 1. 通过靶向 HER2 阳性细胞的 SSHEL 递送阿霉素可减轻小鼠肿瘤异种移植模型中的肿瘤负担。 (A) SSHEL 粒子组装示意图。 1 µm 直径的介孔二氧化硅珠 (灰色,SiO 2 ) 装载货物 (阿霉素,红色),然后将脂质双层 (磷脂酰胆碱) 应用于表面 (黄色) 以创建货物包裹的球形支撑脂质双层 (SSLB)。 然后将 SSLB 与 SpoVM 肽 (蓝色) 和 SpoIVA 蛋白 (绿色) 和 ATP 一起孵育以促进 SpoIVA 聚合。 插图:SpoIVA 含有与反式环辛烯 (TCO) 结合的工程 Cys。与同源点击化学分子四嗪结合的抗 HER2 亲和体 (蓝色星号) 孵育会形成共价二氢哒嗪键,从而导致亲和体显示在 SSHEL 表面。(B) 显示用 Alexa Fluor 488 (AF488) 荧光染料标记的共价连接亲和体的 SSHEL 的荧光显微照片。左图:使用 DIC 可视化的 SSHEL;右图:来自 AF488 的荧光。(C) 使用流式细胞术测量显示抗 HER2 AF488 (绿色) 的 SSHEL 的荧光,并与显示已知数量的等效可溶性荧光染料分子 (MESF) 的珠子产生的荧光进行比较,以计算每个 SSHEL 颗粒显示的抗 HER2 AF488 的数量。(D) 用 SpoIVA AF488 制成的载阿霉素 SSHEL 的荧光显微照片。左上:DIC;右上:SpoIVA AF488 的荧光;左下:阿霉素的荧光;右下:叠加,阿霉素和 SpoIVA AF488 。B 和 D 中的比例尺:1 µm。(EF)无胸腺裸鼠皮下(sc)接种 SKOV3 HER2 阳性卵巢癌细胞。当肿瘤体积达到 ~100 mm 3 时,在异种移植后的几天内,用 PBS(黑色圆圈)、(E) 60 µg 或 (F) 120 µg 阿霉素(红色方块)、含有等效剂量阿霉素的载阿霉素 SSHEL(绿色三角形)或不含货物的等效数量 SSHEL(蓝色倒三角形)对小鼠进行静脉内 (iv) 治疗,箭头所示(试验 1 为 18、21、25、28、32、35、39、43、46、50、54;试验 2 为 13、16、20、23、27、30、34、37),并测量肿瘤体积。数据点代表平均值;误差为 SD;n=7 只小鼠。P 值:*<.05;****<.001。 (GH) 分别在 (G) 第 60 天、(H) 第 41 天 (H,左) 或第 47 天 (H,右) 从 (EF) 小鼠体内切除的肿瘤。红色星号:溃疡肿瘤;蓝色星号:肿瘤 >1500 mm 3 ;橙色星号:从体重减轻 >10% 的小鼠体内切除的肿瘤。比例尺:10 mm。
含有辛伐他汀和阿霉素的活性肿瘤靶向纳米制剂可抑制黑色素瘤的生长和血管生成
1 罗马尼亚克卢日-纳波卡巴别斯-博雅依大学生物与地质学院综合生物学博士学院,2 罗马尼亚克卢日-纳波卡巴别斯-博雅依大学生物与地质学院系统生物学、生物多样性与生物资源中心分子生物学与生物技术系,3 德国慕尼黑工业大学医学院皮肤病学与过敏学系,4 罗马尼亚克卢日-纳波卡巴别斯-博雅依大学生物纳米科学跨学科研究所分子生物学中心,5 罗马尼亚克卢日-纳波卡 NIRDBS 布加勒斯特分校生物研究所实验生物学与生物化学系,6 罗马尼亚 Iuliu Hatieganu 医药大学药学院制药技术与生物制药学系,罗马尼亚 克卢日-纳波卡
磁性固体脂质纳米粒的制备及作为阿霉素靶向药物输送系统的表征
简介 最引人注目的化疗形式之一是细胞毒药物。细胞毒药物可以说是一类不同的治疗剂。有趣的是,这种药物治疗癌症的主要方式是对快速分裂和生长的细胞产生毒性。1 作为一种化疗药物,阿霉素 (DOX,图 1 ) 是治疗早期和晚期乳腺癌的主要药物之一。然而,无论其有效性如何,它都会导致一系列不良的副作用,尤其是不可逆的心脏毒性和可逆的肾毒性;这些副作用导致了许多不同的 FDA 批准的载体的开发。DOX 的抗肿瘤作用小于或等于已批准的载 DOX 的纳米载体。这些载体通过增强血管通透性和滞留作用增加这些载体在肿瘤中的蓄积,从而改善癌症治疗。然而,现有的 DOX 药物递送制剂的一个重要问题是对表现出多药耐药性的肿瘤缺乏疗效。作为一种选择,由于含有 DOX 的 NP 被内吞并位于核周膜附近,细胞
甲硫替平可增强针对耐药黑色素瘤细胞的化疗疗效
摘要:我们之前曾报道过,甲硫替平是一种小分子,被称为非选择性血清素 5-HT 受体拮抗剂,可抑制 Hedgehog 受体 Ptch1 的阿霉素流出活性,并增强阿霉素对肾上腺皮质癌细胞的细胞毒性、促凋亡、抗增殖和抗克隆形成作用。本文表明,甲硫替平还可抑制阿霉素流出,并增加内源性过表达 Ptch1 的黑色素瘤细胞中的阿霉素细胞毒性。患有 BRAF V600E 突变的黑色素瘤患者可使用 BRAF V600E 抑制剂维莫非尼治疗,通常与 MEK 抑制剂曲美替尼联合使用。几乎所有患者最终都会对治疗产生耐药性,导致病情进展。本文报告称,甲硫替平通过增强维莫非尼和曲美替尼对这些细胞的细胞毒性,导致黑色素瘤细胞死亡,从而克服了 BRAF V600E 黑色素瘤细胞的耐药性。我们观察到,在维莫非尼中添加甲硫替平比单独使用维莫非尼更有效地阻止了耐药黑色素瘤细胞的迁移。我们的研究结果进一步证明,Ptch1 药物外排抑制可提高抗癌治疗的有效性,并克服表达 Ptch1 的黑色素瘤细胞的耐药性。
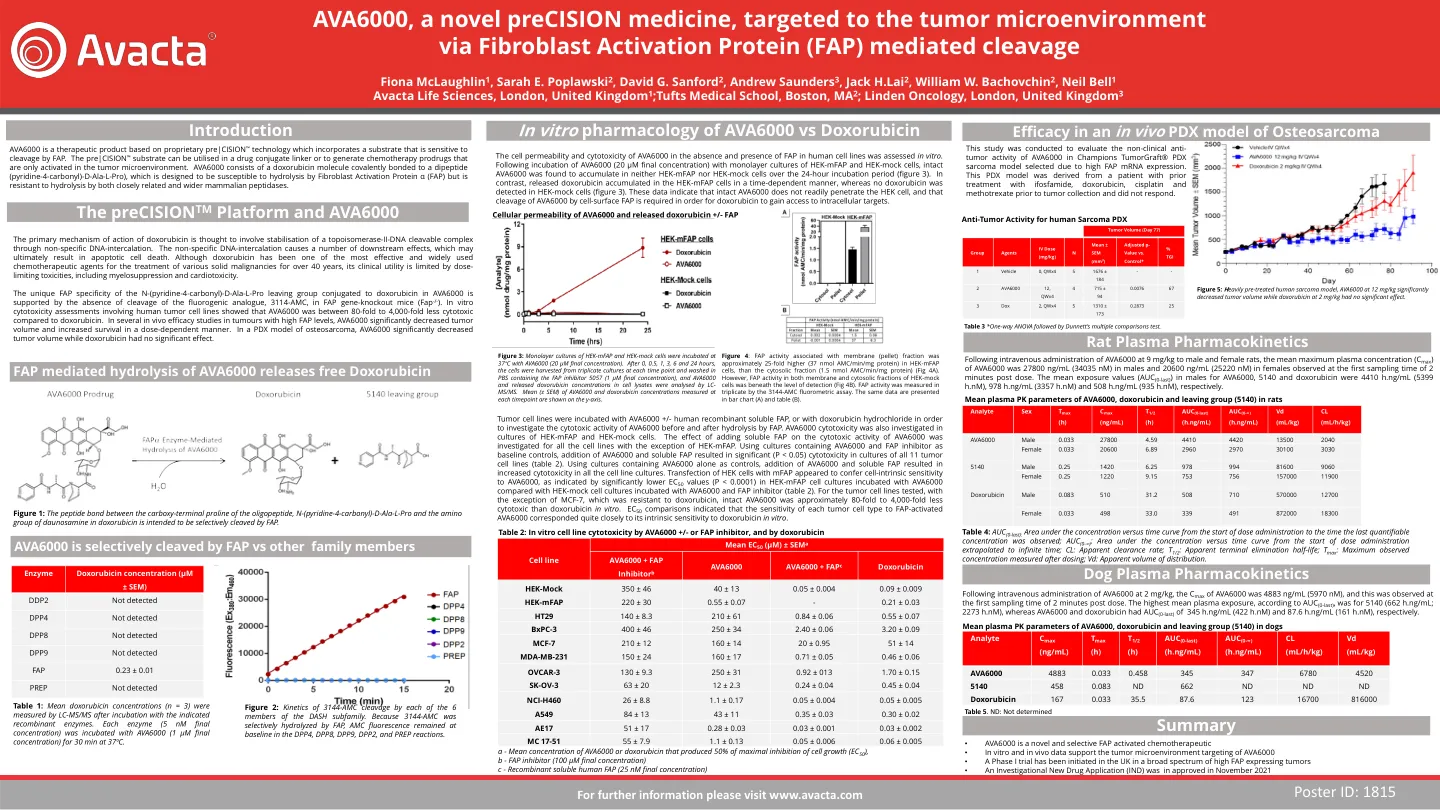
AVA6000,一种针对肿瘤微环境的新型精密药物
肿瘤细胞系与AVA6000 +/-人重组可溶性FAP或盐酸阿霉素孵育,以研究FAP水解前后AVA6000的细胞毒性活性。AVA6000细胞毒性还研究了HEK-MFAP和HEK MOCK细胞的培养物。研究了所有细胞系的添加可溶性FAP对AVA6000的细胞毒性活性的影响,但HEK-MFAP除外。使用含有AVA6000和FAP抑制剂作为基线对照的培养物,添加AVA6000和可溶性FAP导致所有11种肿瘤细胞系的培养物中显着(P <0.05)的细胞毒性(表2)。使用仅包含AVA6000作为对照的培养物,添加AVA6000和可溶性FAP导致所有细胞系培养物的细胞毒性增加。用MFAP转染HEK细胞似乎赋予了对AVA6000的细胞中性敏感性,如与用AVA6000孵育的Hek-Mock细胞培养物孵育的Hek-MFAP细胞培养物中EC 50值(P <0.0001)的明显较低的EC 50值(P <0.0001)所示(P <0.0001)。对于测试的肿瘤细胞系,除了对阿霉素具有抗药性的MCF-7外,完整的AVA6000在体外比阿霉素少了80倍至4,000倍。ec 50比较表明,每种肿瘤细胞类型对FAP激活的AVA6000的敏感性与其对阿霉素在体外的固有敏感性非常接近。
在Glibenclamide中作为候选药物的研究...
与目前市场上的抗癌药物相关的副作用的严重程度包括潜在的致命副作用,例如心脏毒性在阿霉素的情况下。这项研究旨在找到副作用低的新抗癌药物候选者。这项研究中使用的研究设计是在2023年8月在技术,科学和健康RSUD DR的化学实验室进行的干燥实验室实验研究。 Soepraoen。在计算机方法中是发现新药候选物的计算方法。从PubChem数据库获得了Glibenclamide和阿霉素的配体,而从瑞士模型数据库获得的靶蛋白MAP2K1作为受体。在这项研究中,使用PYMOL装置制备配体和蛋白质,并且从PyRX设备获得的对接结果是结合亲和力值。蛋白质与glibenclamide和阿霉素之间的结合亲和力分别为-9.9 kkal/mol和-8.8 kkal/mol,使用Pymol可视化对接结果。这些化合物的结合比结合阿霉素的化合物的结合效果不太紧密,但它们仍然与MAP2K1蛋白相互作用。 PLIP(蛋白质 - 配体相互作用探测器)可用于可视化这些相互作用的效果。根据研究结果,Glibenclamide化合物与MAP2K1蛋白具有良好的相互作用,这可能使它们成为未来癌症药物的有希望的靶标。在硅中是发现新药的第一步,因此为了验证这些发现,在生化,体外和体内需要进一步的研究。