XiaoMi-AI文件搜索系统
World File Search System靶向癌症治疗
Lymphoma: Ibritumomab tiuxetan (Zevalin) , denileukin diftitox (Ontak) , brentuximab vedotin (Adcetris) , rituximab (Rituxan) , vorinostat (Zolinza) , romidepsin (Istodax) , bexarotene (Tartene) , borzotremi (Velcatremia) (Velcatremia) tyn) , ibrutinib (Imbruvica) , siltuximab (Sylvant) , idelalisib (Zydelig) , belinostat (Beleodaq) , obinutuzumab (Gazyva) , nivolumab (Opdivo) , pembrolizumab (Keytruda) , rituximab and hyaluronidase (Rhuman hydroxide) Aliqopa) , axicabtagene ciloleucel (Yescarta) , acalabrutinib (Calquence) , tisagenlecleucel (Kymriah) , venetoclax (Venclexta) , mogamulizumab-kpkc (Poteligeo) , duvelisib (Copiktra) , poltuzutinib-poladopinib (Bruxiq, Zanquiq) insa) , tazemetostat hydrobromide (Tazverik) , selinexor (Xpovio) , tafasitamab-cxix (Monjuvi) , brexucabtagene autoleucel (Tecartus) , crizotinib (Xalkori) , umbralisib tosylate (Ukoniq) , mara lisocab (Bleugene)
仅通过医疗福利覆盖的药物
Brand Name Generic Name ARALAST NP ALPHA-1-PROTEINASE INHIBITOR, HUMAN ARRANON NELARABINE ARZERRA OFATUMUMAB VIAL APHEXDA MOTIXAFORTIDE ASCLERA POLIDOCANOL ASPARLAS CALASPARGASE PEGOL-MKNL AVASTIN BEVACIZUMAB AVEED TESTOSTERONE UNDECANOATE INJECTION AZATHIOPRINE INJECTION AZEDRA IOBENGUANE IODINE-131 BAL IN OIL DIMERCAPROL BAVENCIO AVELUMAB BCG LIVE, INTRAVESICAL BELEODAQ BELINOSTAT BELRAPZO BENDAMUSTINE BENDEKA BENDAMUSTINE BENLYSTA BELIMUMAB VIAL BEOVU BROLUCIZUMAB-DBLL BEQVEZ FIDANACOGENE ELAPARVOVEC-DZKT BESPONSA INOTUZUMAB OZOGAMICIN BICNU CARMUSTINE BLEOMYCIN BLINCYTO BLINATUMOMAB BORTEZOMIB BREYANZI LISOCABTAGENE MARALEUCEL BRIVIACT BRIVARACETAM VIAL BUSULFEX BUSULFAN INJECTION BYFAVO REMIMAZOLAM BYOOVIZ RANIBIZUMAB-NUNA CAFCIT CAFFEINE CITRATE INJECTION CALCITRIOL INJECTION CAMPTOSAR IRINOTECAN CARBOCAINE Mepivacaine Carboplatin Cannitor Levocannitine注入Carvykti Ciltacabtagene Autoleucel casgevy casgevy exagamglogene autotemcel autotemcel cerebel cerebyx fosphenytoin
关于嵌合抗原受体 (CAR) T 细胞的事实...
前两种自体 CAR-T 细胞疗法 tisagenlecleucel (Kymriah®) 和 axicabtagene ciloleucel (Yescarta®) 于 2017 年获得美国食品药品管理局批准。2020 年,FDA 批准了 brexucabtagene autoleucel (Tecartus TM )。Lisocabtagene maraleucel (Breyanzi®) 和 idecabtagene vicleucel (Abecma®) 于 2021 年获得批准。Ciltacabtagene autoleucel (Carvykti TM ) 于 2022 年 3 月获得批准。这些产品和其他目前正在开发的产品要投入临床实践,需要各方充分了解在癌症患者中使用这些个性化“活”生物制剂的技术和医疗管理。本出版物将解释 CAR T 细胞疗法背后的原理,描述已批准的疗法,总结迄今为止的疗效结果,详细说明已出现的重大风险,提供实用的医疗管理信息,并强调该疗法预期融入临床实践所涉及的一些独特挑战。
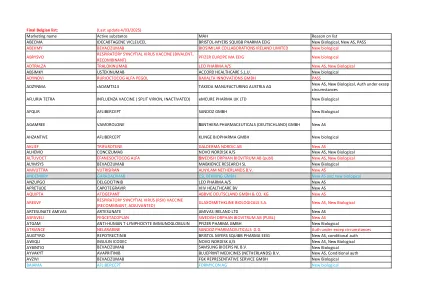
比利时最终名单
BEKEMV ECULIZUMAB 安进科技(爱尔兰) UC 新生物 BENLYSTA BELIMUMAB 葛兰素集团有限公司 新 AS BEYFORTUS NIRSEVIMAB 赛诺菲 WINTHROP INDUSTRIE 新 AS、新生物 BEYONTTRA ACORAMIDIS BRIDGEBIO EUROPE BV 新 AS BIMERVAX 新冠疫苗(重组佐剂型) HIPRA HUMAN HEALTH, SLU 新 AS、新生物 BIMZELX BIMEKIZUMAB UCB PHARMA SA 新 AZ、新生物 BLINCYTO BLINATUMOMAB 安进欧洲 BV PASS BYOOVIZ RANIBIZUMAB 三星 BIOEPIS NL BV 新生物 BREYANZI LISOCABTAGENE MARALEUCEL 百时美施贵宝制药 EEIG 新生物、新 AS、PASS BRINEURA CERLIPONASE ALFA BIOMARIN INTERNATIONAL LTD 授权,除非情况允许,PASS BRIUMVI UBLITUXIMAB NEURAXPHARM PHARMACEUTICALS, SL 新 AS,新生物 BYFAVO REMIMAZOLAM PAION DEUTSCHLAND GMBH 新 AS BRUKINSA ZANUBRUTINIB BEIGENE IRELAND LIMITED 新 AS
2024年1月19日安全标签变更通知信
2024年1月19日,朱诺治疗公司,布里斯托尔 - 明年的squibb公司的注意:梅根·菲茨杰拉德(Megan Fitzgerald)1000 Dexter Ave.《联邦食品,药物和化妆品法》(FDCA)的第505(o)(4)条授权FDA要求批准的药物和有执照的生物产品应用程序持有人,以根据批准药物或生物学产品后获得的新安全信息进行安全标签更改。自从2021年2月5日批准了利斯甲基省马拉莱甲基(Breyanzi)以来,我们已经意识到用T细胞恶性肿瘤的风险,包括严重的结果,包括住院和死亡,在BCMA-和CD19指导的基因基因遗传学T细胞免疫疗法中进行了治疗。FDA在用BCMA和CD19指导的遗传自体T细胞免疫疗法治疗后,确定了销售后不良事件和临床试验报告,描述了发生成熟T细胞恶性肿瘤,包括CAR阳性肿瘤。有关其他信息,请参阅CBER安全通信的标题为“ FDA调查BCMA导向或CD19指导自体嵌合抗原受体(CAR)T细胞免疫疗法后T细胞恶性肿瘤的严重风险”,并于2023年7月 - 9月至9月 - | FDA不良事件报告系统(FAERS)确定的严重风险/新安全信息的潜在信号| FDA用于BCMA或CD19的转基自体T细胞免疫疗法。我们将此信息视为FDCA第505-1(b)(3)节中定义的“新安全信息”。此外,我们认为T细胞恶性肿瘤的严重风险适用于所有BCMA和CD19指导的转基自体T细胞免疫疗法。根据FDCA的第505(o)(4)条,我们通知您,基于上述新的安全信息,并在2024年1月19日在Telecon上进行了讨论,我们已经确定应将新的安全信息包括在所有BCMA和CD19和CD19的标签中,并进行了基因遗传改良的
医疗补助扩展限制使用列表 - 预先认证
avasttin(仅OCTTIN诊断)bevacizumab(仅刻薄诊断)C9257 J9035 AVSOLA英夫斯洛拉英夫利昔单抗-AXXQ Q5121 avzivi bevacizumab-tnjn A9590 Bavencio avelumab J9023 Beleodaq Belinostat J9032 Belrapzo Bendamistine J9036 Bendeka Benlysta(iv)Belimumab J0490 Beqvez findacogene findacogene elaparvovece elaparvovec j1414 besponsa besponsa besponsa besponsa besponsa besponsa besponsa besponsa Inotuzumab J9229 Bivigam Immune Globulin(人)IV J1556 Blincyto Blinatumomab J9039 Botox Onbotulanum毒素A J0585 Beryanzi lisocababtagene lisocabtagene Maraleucel Maraleucel Q2054 Brainneura cerliponase alfa j0567 j0567 bkem j0567 bkem Eculizumab-AEEB Q5139 Carimune纳米滤器IV J1566 Carticogos软骨细胞J7330 Ciltacabtagene Autoleucel Q2 J3392 Cerezyme Imiglucerase J1786 CINQAIR RESLIZUMAB J2786 COLUMVII GLOFITAMAB-GXBM J9286 COSELA TRILACICLIB J1448 COSENTYX IV SECUKINUMAB J3247 CRYSVITA BURODUMUMAB J055 cUSTAMAB J0584 CUTAUNEN4 CUTAUNEN4 (Human) subcutaneous j1551 cumtru immune globulin (human) subcutaneous j1555 cyramza ramucirub j9308 daanyelza naxitamab-gqgk j9348 darzalex daratuummab j9145 darzalex fasprondase-fihjj J9144 DAXXIFY DAXIBOTULLINUMTOXINA-LANM J0589 DURALANE透明质酸J7318,
关于再生医学和CCRM的快速事实
再生医学行业概述再生医学,包括细胞和基因疗法(CGTS),利用(干)细胞,生物材料,分子和遗传修饰的功率来修复,再生或替代患病的细胞,组织和器官。这种方法正在破坏传统的生物技术和制药行业,并有望为诸如心脏病,糖尿病和癌症等毁灭性疾病的革命性新疗法提供新的治疗方法。行业快照•2023年全球再生医学市场的价值为304.4亿美元,预计到2034年将增长到1680亿美元。1•2023年筹集了11.7B美元,再生医学联盟(ARM)称其为“该行业的强大基础”。截至2024年4月30日,ARM报告说,已在第1季度筹集了7.1b美元。2•截至2024年4月,全球有2,848个CGT开发人员,比第4季度2023年增长了11%。北美有1,222个,亚太地区有972个,欧洲有561个,其他地方有93个。3•截至2024年4月,全球再生医学中有1,751次主动临床试验。在细胞疗法中有442个,基因治疗中有586例,757在基于细胞的免疫肿瘤学中。在第三阶段临床试验中有5%。35%在极少数情况下,肿瘤学中有58%。4•仅在美国,预计将在2030年之前接受CGT的治疗。5•与其他工业化国家相比,加拿大生物医学研发的成本竞争力排名第二。 2024),辉瑞的beqvex(dec.5•与其他工业化国家相比,加拿大生物医学研发的成本竞争力排名第二。2024),辉瑞的beqvex(dec.最近的6个里程碑•迄今为止,在加拿大批准了11个CGT,并且在全球范围内已批准34个CGT。•最近的一些CGT批准包括:o加拿大卫生部:Bristol Myers Squibb的Breyanzi,用于R/R大B细胞淋巴瘤(3月
关于再生医学和CCRM的快速事实
再生医学,包括细胞和基因疗法,可以利用(干)细胞,生物材料,分子和遗传修饰的能力修复,再生或替代患病的细胞,组织和器官。这种方法正在破坏传统的生物技术和制药行业,并有望为诸如心脏病,糖尿病和癌症等毁灭性疾病的革命性新疗法提供新的治疗方法。行业•2018年全球再生医学市场的价值为23.8B美元,预计到2026年,预测在预测期内的复合年增长率为26.1%。1•全球,再生医学公司在2020年筹集了超过19.9亿美元的筹集费用,超过了2018年创下的13.5B美元的先前记录。2•仅在美国,预计将在2030年之前使用细胞和基因疗法进行治疗。3•截至2020年底,在国际监管机构批准的再生医学和先进疗法产品中进行了1,220个临床试验,其中包括III期开发中的152个。2•大多数临床试验是在肿瘤学中(554),其次是中枢神经系统(94)和单基因疾病(87)。2•与其他工业化国家相比,加拿大生物医学研发的成本竞争力排名第二。4•北美拥有39%的全球再生医学市场。5再生医学行业活动的强度增加。•2021年2月,加拿大的Notch Therapeutics宣布关闭超额认购的A系列A融资。_______________ *除非另有说明,否则美元金额为CAD。最近,我们已经看到了以下几点:•选择新细胞和基因疗法的最新认可包括布里斯托尔·迈尔斯·斯皮布布(Bristol Myers Squibb)的Abecma(2021年5月),诺华Zolgensma(2020年12月),卢克斯特纳(Luxturna),卢克斯特纳(Luxturna)(2020年10月)和凯姆利亚(Kymriah)(2018年9月),加拿大加拿大卫生部,布里斯托尔·米尔斯·米尔斯·米尔斯·米尔斯·米尔斯·米勒·米尔·米尔·米兰(Hearne) (2020年7月)和耶斯卡塔(2018年3月),以及美国食品药品监督管理局的诺华Zolgensma(2019年5月),以及欧洲药品协会的Bluebird Bio Bio的Zynteglo(2019年3月)。在2019年11月,同种异体治疗剂和加拿大的Notch Therapeutics宣布了一项合作,以研究和开发用于血液学癌症适应症的多能干细胞衍生的同种异体疗法。Notch Therapeutics于2019年启动,是CCRM孵化计划的第一个“研究生”。•2020年10月,Emmanuelle Charpentier和Jennifer Doudna因发现CRISPR/CAS9遗传编辑工具而被授予诺贝尔化学奖2020年•2019年8月,拜耳对BlueRock AG的1B $ 1B收购,2019年8月向Toronto展示了Toronto的研究能力研究,制造和商业化。Bluerock Therapeutics的心脏计划利用多伦多大学健康网络的Gordon Keller博士利用知识产权,CCRM支持制造平台。•2018年7月,Avrobio在纳斯达克的首次公开募股中筹集了超过1亿美元。Avrobio由CCRM共同创立,并已从CCRM当前的投资组合公司清单中退出。网站,2021年2月2日再生医学联盟2020年年度报告3 Quinn等。(2019)。健康期刊的价值,22(6)。1通过产品(细胞疗法,基因疗法,组织工程,富含血小板的血浆)的再生医学市场规模,份额和行业分析,通过应用(骨科,伤口护理,肿瘤学),分销渠道(医院,诊所)和区域预测,2019 - 2026年。估计细胞和基因疗法的临床管道及其对美国医疗保健系统的潜在经济影响。621-626。 https://doi.org/10.1016/j.jval.2019.03.014 4 kpmg竞争替代品,2016年5全球再生药物市场 - 分析和预测(2017-2025)(重点是治疗,应用,应用,应用,市场份额,22个国家份额分析,22个国家分析,竞争性景观)。reportlinker.com。网站,2020年3月
RSV免疫,耐用性和再感染 药学微生物手册 行业急性髓样白血病指南 FDA信件呼吁提高婴儿配方奶粉行业的安全措施(2023年3月) 课程vitae stephen clement,MD 人类处方药和生物产品标签的老年信息针对行业的标签指南 卫生与公共服务部 嗜酸性食管炎:开发治疗药物 用户费用法(PDUFA)重新授权 吸入抗真菌产品的调节视角 聚丙烯:医疗设备材料安全摘要 药物开发工具意向书确定DDT COA ... 包装插入-Fluad 从研究到紧急使用授权的Covid-19疫苗的路径 准备复杂的多价免疫原性结合物的方法 gras通知GRN 900代理响应信 阿片类镇痛药的背景REMS 包装插入-Fluad Quadrivalent 行业指南 2020年11月13日临床评论备忘录-Breyanzi 请求联合产品的FDA反馈 疫苗和相关生物产品咨询委员会2020年12月17日会议简报文件 - 赞助商附录 Moderna Covid-19疫苗VRBPAC简报 在用于药物和生物产品的复杂创新试验设计上与FDA互动 行业指南
•人类对RSV的免疫反应和潜在的新型治疗靶标的摘要。除关键抗体,细胞因子,趋化因子和其他免疫分子反应外,总结了主要细胞类型(中性粒细胞,树突状细胞,巨噬细胞,CD8 T细胞和B细胞)的作用。显示了与免疫相关途径的主要转录变化(在外周血中)。强调了中性粒细胞炎症的有害作用和CD8 T细胞介导的病毒清除率的保护作用。最后,我们重点介绍了新型治疗干预措施可能会调节免疫反应以有利于宿主的领域。1,免疫细胞募集到呼吸道; *,与疾病严重程度增加相关。