XiaoMi-AI文件搜索系统
World File Search System免疫者疫苗诊所资源
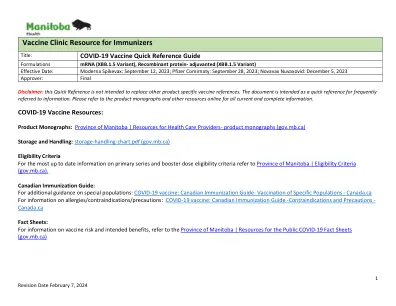
标题:COVID-19 疫苗快速参考指南配方 mRNA(XBB.1.5 变体),重组蛋白佐剂(XBB.1.5 变体)生效日期:Moderna Spikevax:2023 年 9 月 12 日;Pfizer Comirnaty:2023 年 9 月 28 日;Novavax Nuvaxovid:2023 年 12 月 5 日批准者:最终免责声明:本快速参考并非旨在取代其他产品特定的疫苗参考。该文件旨在作为经常参考信息的快速参考。有关所有最新和完整的信息,请参阅产品专论和其他在线资源。COVID-19 疫苗资源:产品专论:马尼托巴省 |医疗服务提供者资源 - 产品专论 (gov.mb.ca) 储存和处理:storage-handling-chart.pdf (gov.mb.ca) 资格标准 有关初级系列和加强剂量资格标准的最新信息,请参阅马尼托巴省 | 资格标准 (gov.mb.ca)。 加拿大免疫指南: 有关特殊人群的更多指导:COVID-19 疫苗:加拿大免疫指南 - 特定人群的疫苗接种 - Canada.ca 有关过敏/禁忌症/注意事项的信息:COVID-19 疫苗:加拿大免疫指南 - 禁忌症和注意事项 - Canada.ca 情况说明书: 有关疫苗风险和预期益处的信息,请参阅马尼托巴省 | 公众资源 COVID-19 情况说明书 (gov.mb.ca)
杆状病毒-昆虫细胞系统的基因工程以提高蛋白质产量
杆状病毒表达载体系统 (BEVS) 是一种成熟的外源蛋白表达平台,已问世数十年,并已有效用于疫苗生产、基因治疗和许多其他应用。迄今为止,已有 11 种 BEVS 衍生产品获批使用,包括四种人用疫苗 [Cervarix 针对人乳头瘤病毒 (HPV) 引起的宫颈癌、Flublok 和 Flublok Quadrivalent 针对季节性流感、Nuvaxovid/Covovax 针对 COVID-19]、两种人用治疗剂 [Provenge 针对前列腺癌和 Glybera 针对遗传性脂蛋白脂肪酶缺乏症 (LPLD)] 和五种兽用疫苗(Porcilis Pesti、BAYOVAC CSF E2、Circumvent PCV、Ingelvac CircoFLEX 和 Porcilis PCV)。BEVS 具有许多优点,包括安全性高、操作简便、适用于无血清培养。它还能产生正确折叠的蛋白质,并具有正确的翻译后修饰,并且可以容纳多基因或大基因插入。然而,该系统仍然存在一些挑战,包括表达不稳定和蛋白质糖基化水平降低。随着对生物技术的需求不断增加,人们也开始通过基因工程和操纵杆状病毒载体和宿主细胞来优化产量、稳定性和蛋白质糖基化。在这篇综述中,我们总结了近年来 BEVS 的策略和技术进步,并探讨了如何利用这些来指导该系统的进一步开发和应用。
COVID-19 疫苗接种和过敏常见问题解答
您对 COVID-19 疫苗(包括加强剂)和过敏症有疑问吗?我们整理了一份最常见问题列表,并在临床小组和英国过敏和临床免疫学会成员的帮助下整理了答案。目前,英国有六种疫苗获准供应,分别是辉瑞/BioNTech 疫苗 (Comirnaty)、阿斯利康疫苗 (Covishield)、Moderna 疫苗 (Spikevax)、杨森疫苗、Novovax (Nuvaxovid) 和 Valneva 疫苗。您可以在此处访问辉瑞/BioNTech COVID-19 疫苗接种患者信息传单 可在此处获取医疗专业人员的信息 您可以在此处访问阿斯利康疫苗患者信息传单 可在此处获取医疗专业人员的信息 您可以在此处访问 Moderna 患者信息传单 可在此处获取医疗专业人员的信息 您可以在此处访问 Janssen 患者信息传单 可在此处获取医疗专业人员的信息 您可以在此处访问 Novovax 患者信息传单 可在此处获取医疗专业人员的信息 您可以在此处访问 Valneva 患者信息传单 可在此处获取医疗专业人员的信息 绿皮书包含有关英国可通过疫苗预防的传染病的疫苗和疫苗接种程序的最新信息。有关 COVID-19 疫苗接种的最新更新于 2022 年 2 月 28 日发布,可在此处找到。
四种 COVID-19 疫苗在基础剂量中的安全性 1 ...
摘要:澳大利亚批准使用四种 COVID-19 疫苗:辉瑞-BioNTech BNT162b2(Comirnaty)、阿斯利康 ChAdOx1(Vaxzevria)、Moderna mRNA-1273(Spikevax)和 Novavax NVX-CoV2373(Nuvaxovid)。我们试图检查在接种第 1、2、3 剂和加强剂后第 3 天和第 42 天的免疫后不良事件 (AEFI)。我们在 2021 年 8 月至 2022 年 4 月期间与 AusVaxSafety 合作,对澳大利亚 130 家社区药房进行了主动疫苗安全监测。主要结果:接种疫苗后 0-3 天的 AEFI;接种疫苗后 3 天和 42 天的医学审查/建议; SARS-CoV-2 在第 42 天出现突破性感染。在 110,024 份完成的第 3 天调查中(回复率为 43.6%),50,367 份(45.8%)报告了任何 AEFI(最高比例:辉瑞 42%,初级剂量 3;阿斯利康 58.3%,初级剂量 1;Moderna 65.4% 和 Novavax 58.8%,均为初级剂量 2)。所有剂量/疫苗中报告的最常见 AEFI 是局部反应、全身疼痛和疲劳/倦怠。总体而言,2172/110,024(2.0%)和 1182/55,329(2.1%)受访者分别在第 3 天和第 42 天寻求医疗复查,931/42,318(2.2%)报告在第 42 天出现突破性 SARS-CoV-2 感染。我们发现了相似的 AEFI 特征,但辉瑞、阿斯利康、Moderna 和 Novavax COVID-19 疫苗的比例低于之前报告的比例。Moderna 疫苗的反应性最强,并且在第 2、3 剂和加强剂中与较高的 AEFI 比例相关。
疫苗 - 医生论坛
• 国药 BIBP 新冠疫苗(两剂,间隔三至四周) • 科兴新冠疫苗(两剂,间隔两至四周) • 阿斯利康新冠疫苗(两剂,间隔八至十二周) • Bharat Biotech 新冠疫苗(两剂,间隔四周) • Novavax/Nuvaxovid 新冠疫苗(两剂,间隔三周) 问:如果我获得了新冠疫苗接种的批准,是否会有任何其他适用于我的工作场所规则或限制? 答:是的。任何未接种疫苗的人都必须在 NM 设施内佩戴口罩,每周接受一次新冠检测,并且可能接受额外的安全预防措施。NM 可能还需要实施 CMS 或其他监管机构定义的其他规则。未满足每周检测要求的员工将接受纠正措施,直至被解雇。未能检测或完成证明的纠正措施可以与任何其他纠正措施累积起来。问:我的经理会知道我的 COVID-19 疫苗接种情况吗?答:是的。与受雇和签约员工的流感疫苗接种/住宿情况类似,他们也将能够看到 COVID-19 疫苗接种或住宿情况,以协助遵守规定。(如果您有住宿,您的经理将不会被告知住宿的原因。)更新问:我在哪里可以接种 COVID-19 疫苗?答:大多数 NM 紧急护理中心提供更新的单剂量 Omicron 加强剂以及辉瑞 COVID-19 疫苗。访问 nm.org 了解每个 ICC 提供疫苗的日期、时间和地点。如果您出示您的徽章,您的疫苗信息将上传到您的员工健康记录中。
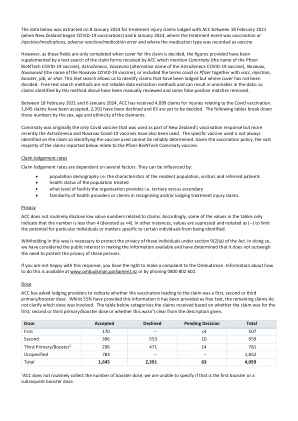
COVID-19 疫苗接种声明更新 - 2024 年 1 月
以下数据摘录于 2024 年 1 月 8 日,针对 2021 年 2 月 18 日(新西兰开始接种 COVID-19 疫苗)至 2024 年 1 月 6 日期间向 ACC 提交的治疗伤害索赔,其中治疗事件为疫苗接种或注射/药物、不良反应/用药错误,药物类型记录为疫苗。但是,由于这些字段仅在决定索赔承保范围时才填写,因此所提供的数字已通过对 ACC 收到的索赔表格进行文本搜索来补充,其中提到 Comirnaty(辉瑞-BioNTech COVID-19 疫苗的名称)、阿斯利康、Vaxzevria(阿斯利康 COVID-19 疫苗的替代名称)、Novavax、Nuvaxovid(Novavax COVID-19 疫苗的名称),或包括术语 covid 或辉瑞以及 vacc、注射、加强针、jab 或 shot。此文本搜索使我们能够识别已提交但尚未决定承保范围的索赔。自由文本搜索方法不是可靠的数据提取方法,可能会导致数据异常;因此,已对上述方法识别的索赔进行了手动审查,并删除了一些误报匹配。2021 年 2 月 18 日至 2024 年 1 月 6 日期间,ACC 收到了 4,099 起与 Covid 疫苗接种有关的伤害索赔。1,645 项索赔已被接受,2,391 项索赔已被拒绝,63 项索赔尚未决定。下表按索赔人的性别、年龄和种族细分了这些数字。Comirnaty 最初是新西兰疫苗接种反应中唯一使用的新冠疫苗,但最近阿斯利康和 Novavax 新冠疫苗也被使用。索赔中并不总是标明所使用的具体疫苗,因此无法可靠地确定所使用的疫苗。鉴于疫苗接种政策,以下报告的绝大多数索赔与辉瑞-BioNTech Comirnaty 疫苗有关。索赔提交率
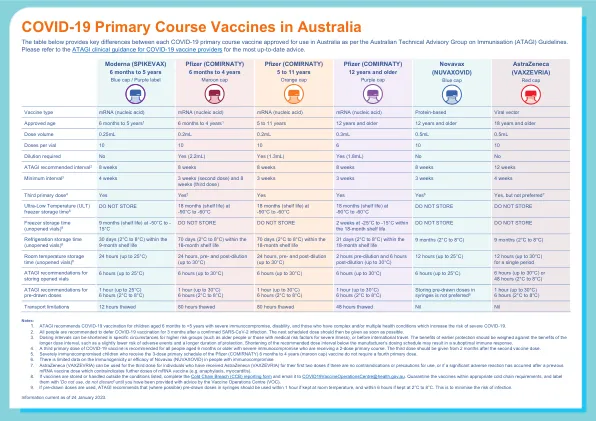
澳大利亚的 COVID-19 初级疫苗
1. ATAGI 建议 6 个月至 5 岁以下患有严重免疫功能低下、残疾以及患有复杂和/或多种健康状况(会增加患严重 COVID-19 风险)的儿童接种 COVID-19 疫苗。2. 建议所有人在确诊感染 SARS-CoV-2 后 3 个月内推迟接种 COVID-19 疫苗。然后应尽快接种下一剂疫苗。3. 对于高风险人群(例如老年人或具有严重疾病医学风险因素的人)或在国际旅行前,可以在特定情况下缩短给药间隔。应权衡早期保护的好处与较长剂量间隔的好处,例如不良事件风险略低和保护时间更长。将推荐剂量间隔缩短至低于制造商的给药时间表可能会导致免疫反应不佳。4. 对于所有 6 个月或以上患有严重免疫功能低下并正在接受 2 剂基础疗程的人,建议接种第三剂 COVID-19 疫苗。第三剂应在第二剂疫苗接种后 2 个月开始接种。5. 已接种 3 剂辉瑞 (COMIRNATY) 6 个月至 4 岁(栗色帽)疫苗基础剂量的严重免疫功能低下儿童不需要接种第四剂基础剂量。6. 关于 Novavax(NUVAXOVID)对免疫功能低下人群的免疫原性或有效性的数据有限7. 对于前两剂接种过阿斯利康 (VAXZEVRIA) 的个人,如果没有禁忌症或使用注意事项,或者在先前接种 mRNA 疫苗后发生了严重不良反应,从而禁止继续接种 mRNA 疫苗(例如过敏反应、心肌炎),则可以将阿斯利康 (VAXZEVRIA) 用于第三剂。 8. 如果疫苗的储存或处理不符合所列条件,请填写冷链违规 (CCB) 报告表并将其通过电子邮件发送至 COVID19VaccineOperationsCentre@health.gov.au。在适当的冷链要求范围内隔离疫苗,并贴上“请勿使用,请勿丢弃”的标签,直到您收到疫苗操作中心 (VOC) 的建议。9. 如果使用预抽剂量,ATAGI 建议(如果可能)注射器中的预抽剂量应在室温下保存 1 小时内使用,在 2°C 至 8°C 下保存 6 小时内使用。这是为了最大限度地降低感染风险。
2024 年 4 月 26 日 新冠疫苗有效期延长-...
简介 迄今为止,荷兰已批准五种 COVID-19 疫苗用于主动免疫预防 SARS-CoV-2:BioNTech/辉瑞 (Comirnaty®)、Moderna (Spikevax®)、阿斯利康 (Vaxzevria®)、杨森 (Jcovden®) 和 Novavax (Nuvaxovid®) [1-6]。BioNTech/辉瑞和 Moderna 都是 mRNA 疫苗,阿斯利康和杨森都是基于载体的疫苗,Novavax 是一种含有皂苷基基质-M 免疫刺激佐剂的蛋白质亚单位疫苗。所有五种 COVID-19 疫苗都编码 SARS-CoV-2 刺突糖蛋白,并诱导细胞和体液免疫反应,包括 SARS-CoV-2 中和抗体。辉瑞/BioNTech 疫苗在荷兰的接种频率最高 [7]。淋巴结肿大是指淋巴结大小异常(例如大于 1 cm)或质地异常 [8]。在大多数患者中,淋巴结肿大是良性的,具有自限性。淋巴结肿大的潜在原因是感染、自身免疫性疾病、恶性肿瘤或淋巴增生性疾病。当淋巴结肿大涉及一个区域(例如颈部或腋窝)时,则将其归类为局限性淋巴结肿大。全身性淋巴结肿大定义为涉及两个或更多个区域,并且更常与全身性疾病有关。如果淋巴结肿大持续较长时间,则需要进行诊断检查。这些检查包括血液检查、超声检查、CT 或 PET 扫描,以及最终的活检或切除以进行组织学检查。淋巴结肿大是 COVID-19 疫苗接种后众所周知的不良事件 (AEFI) [1-6]。 2022 年 2 月,荷兰药物警戒中心 Lareb 发表了一份由 BioNTech/Pfizer 或 Moderna 加强疫苗接种引起的淋巴结肿大病例概述 [9]。与第一剂或第二剂疫苗接种相比,加强疫苗的发病时间更短(1 天 vs 2-4 天),严重程度更高。平均持续时间为 6 到 7 天。然而,也收到了描述淋巴结肿大持续时间延长的安全性报告。选择 COVID-19 疫苗接种后最短持续时间为 6 个月且发病时间为 28 天或更短的报告进行进一步研究。通过提取收到安全报告日期和淋巴结肿大开始日期之间的时间来计算未康复或康复病例的持续时间。报告截至 2023 年 8 月 16 日,荷兰药物警戒中心 Lareb 共收到 18,986 份关于 COVID-19 疫苗接种后淋巴结肿大的安全报告。淋巴结肿大开始日期与报告日期之间的中位时间为 2 天(图 1)。由于报告是在发病后不久收到的,大多数病例在报告时尚未康复。因此,根据淋巴结肿大开始日期和安全报告收到日期计算中位持续时间没有意义。对于报告时的康复病例(3,855 例),中位持续时间为 4 天(图 2)。
COVID-19 疫苗接受度、意向和……的影响
2019 冠状病毒 (COVID-19) 的出现对世界产生了显著的负面影响,其影响渗透到商业 [ 1 , 2 ]、教育 [ 3 , 4 ]、健康 [ 5-7 ] 和社会生活 [ 8 , 9 ] 等各个领域。这种危及生命的病毒最早在武汉(中国)报告,死亡率和感染率都很高 [ 10 , 11 ]。这导致世界卫生组织 (WHO) 在三个月内(2020 年 3 月 11 日)将其列为大流行病 [ 10 , 11 ]。此后,世界各国试图通过制定 COVID-19 指南或政策(如隔离、洗手和保持身体距离)来预防和/或控制 COVID-19 [ 12 ]。尽管已经研制出有效的疫苗,但 COVID-19 的负面影响仍然是全世界的重要问题。截至 2023 年 1 月 10 日,全球新冠肺炎病例超过 6.601 亿例,死亡人数超过 660 万 [13]。其中,欧洲 2.705 亿例,美洲 1.87 亿例,西太平洋 1.09 亿例,东南亚 6070 万例,东地中海 2320 万例,非洲 940 万例 [13]。抗病毒药物(或疫苗)的研发迫在眉睫,第一种疫苗于 2020 年 12 月 31 日获批 [14]。截至 2022 年 1 月 12 日,九种疫苗已列入世卫组织紧急使用清单,包括辉瑞/BioNTech 联合疫苗(2020 年 12 月 31 日); SII/COVISHIELD 和 AstraZeneca/AZD1222 疫苗(2021 年 2 月 16 日);Janssen/Ad26.COV 2.S 疫苗(强生公司,美国新泽西州,2021 年 3 月 12 日);Moderna COVID-19 疫苗(mRNA 1273,2021 年 4 月 30 日);国药集团 COVID-19 疫苗(2021 年 5 月 7 日);科兴生物科技股份有限公司新冠疫苗(2021 年 6 月 1 日);Bharat Biotech BBV152 COVAXIN 疫苗(2021 年 11 月 3 日);Covovax (NVX-CoV2373) 疫苗(2021 年 12 月 17 日);以及 Nuvaxovid (NVX-CoV2373) 疫苗(2021 年 12 月 20 日)[14]。由于 COVID-19 的唯一干预措施是疫苗和行为预防措施,世界各国一直在开展研究,以更好地了解其公民对疫苗接种的态度及其与其他 COVID-19 相关变量、社会和/或职业功能、健康状况以及系统中已有的其他疫苗之间的关系。截至 2022 年 12 月 22 日,全球已接种 130.7 亿剂疫苗 [13]。在这 130.7 亿剂中,接种了最后一剂基础疫苗的人数为欧洲 4.387 亿人、美洲 6.368 亿人、西太平洋 17 亿人、东南亚 6.932 亿人、东地中海 3.469 亿人、非洲 2.736 亿人 [15]。为了理解和改进 COVID-19 疫苗接种运动,一些研究人员认为,一些与 COVID-19 相关的变量(例如 COVID-19 压力、对 COVID-19 的恐惧、对 COVID-19 的感知耻辱、对 COVID-19 的自我耻辱以及对 COVID-19 信息的相信)可能在这方面有所帮助 [ 16 – 18 ]。例如,一项研究
接种 COVID-19 疫苗后出现长期类似 COVID 症状
迄今为止,荷兰已批准以下五种 COVID-19 疫苗用于主动免疫 SARS-CoV-2:BioNTech/辉瑞 (Comirnaty®)(1)、Moderna (Spikevax®)(2)、阿斯利康 (Vaxzevria®)(3)、杨森 (Jcovden®)(4) 和 Novavax (Nuvaxovid®)(5)。BioNTech/辉瑞和 Moderna 均为 mRNA 疫苗,阿斯利康和杨森均为载体疫苗,Novavax 为含有皂苷基基质-M 免疫刺激佐剂的蛋白质亚单位疫苗 (1-5)。自荷兰启动针对 SARS-CoV-2 的大规模免疫计划(2021 年 1 月)以来,截至 2023 年 10 月 1 日最新 Corona 仪表板更新,已有 12,370,518 人接受了基础疫苗接种,4,187,145 人在 2022 年秋季的最后一轮重复疫苗接种中接受了重复剂量接种(6、7)。截至 2023 年 8 月 16 日,荷兰药物警戒中心 Lareb 直接从患者和医疗保健专业人员那里收到了 254,293 份有关 COVID-19 疫苗的报告。大多数报告涉及 BioNTech/Pfizer(127,995),其次是 Moderna(53,497)、AstraZeneca(38,036)、Janssen(15,099)和 Novavax(60)。荷兰药物警戒中心 Lareb 旨在调查是否存在特定的临床描述,可以表明迄今为止未知的与 COVID-19 疫苗接种相关的长期不良反应。总共收到 2,282 份报告,共包含 5,245 起长期免疫后不良事件 (AEFI)。长期 AEFI 被定义为在接种 COVID-19 疫苗后发病时间为 28 天或更短且持续时间为 6 个月或更长时间的 AEFI。仅报告恢复的 AEFI 的持续时间。对于未恢复和恢复中的 AEFI,持续时间的假设是通过从报告日期中减去 AEFI 的开始日期来得出的。不符合此条件的报告不会被选中。此外,未选择包含 COVID-19 感染后 28 天内发病的长期 AEFI 的报告,以降低报告的症状与 COVID-19 感染有关的可能性。此外,未选中预计需要很长时间才能恢复的 (严重) AEFI 报告,例如格林-巴利综合征 (GBS) 或各种形式的血栓形成。报告最多的长期 AEFI 是疲劳 (n=531)、肌痛 (n=399)、关节痛 (n=382)、头痛 (n=283) 和不适 (n=250)。较少但同样频繁报告的长期症状是呼吸困难 (n=86) 和心悸 (n=66)。此外,还报告了其他“长期类似 COVID 症状”,例如感觉异常 (33)、肌肉无力 (23) 和注意力障碍 (24)。报告包含多种长期 AEFI 组合。为了了解重点关注何处,对所有选定的长期 AEFI 报告进行了探索性分析。对报告的 AEFI 组合进行了调查,以查看数据中是否存在临床聚集现象。临床评估人员审查了每组个案,以了解是否存在临床描述、患者是否接受过医疗专业人员的诊治、是否进行了诊断程序以及是否做出了诊断,以及其他信息要素。基于此审查,结合科学文献和新闻稿中关于长期 COVID 的病例描述,我们决定进一步重点分析类似长期 COVID 的症状 (8-11)。报告的选择根据前面提到的长期 COVID 病例描述,我们对 COVID-19 感染后长期 COVID 中常见的以下症状组进行了分类:周围神经症状、认知功能障碍症状、心血管症状(包括 POTS)、