XiaoMi-AI文件搜索系统
World File Search Systemerythropoiesis
Kumar S等。兽医医学的未来:整合生物技术以改善动物健康和福利。 OA J Ani植物饲养2024,4(1):180021。manasa K.维生素B12在DNA合成及其临床表现中的作用。 Pharma Sci Analytical Res J 2024,6(4):180115。
维生素B12(钴胺素)是必不可少的微量营养素,在DNA合成,细胞复制和维持基因组稳定性中具有关键作用。其生化功能是通过两个酶促反应介导的,这些酶促反应对于核苷酸生物合成和甲基化循环的正常功能至关重要。首先,维生素B12充当蛋氨酸合酶的辅助因子,蛋氨酸合酶是一种酶,负责将同型半胱氨酸对甲氨酸的再甲基化。蛋氨酸随后转化为S-腺苷硫氨酸(SAM),这是用于DNA,RNA,RNA,蛋白质和脂质甲基化的主要甲基供体供体。DNA甲基化是调节基因表达的关键表观遗传机制,可确保正确的染色质结构和基因组稳定性。由于维生素B12缺乏而导致的该途径中的破坏会导致异常的DNA甲基化模式,这些模式与各种病理状况有关,包括癌症,心血管疾病和神经退行性疾病。其次,维生素B12参与通过甲基甲基甲基甲酰基-COA突变酶转化甲基甲硅烷-COA到琥珀酰-COA。这种反应对于奇数链脂肪酸和某些氨基酸的分解代谢至关重要,并且在DNA的构成块的脱氧核糖核苷酸的合成中也起作用。由于维生素B12缺乏而导致的甲基甲硅烷-COA突变酶的功能受损导致甲基甲酸的积累,这会破坏线粒体功能并有助于神经毒性。在临床上,维生素B12缺乏表现出各种血液学和神经系统症状。最值得注意的是大型贫血贫血,其特征是血液中存在大型,不成熟和功能失调的红细胞。这种情况是由DNA合成受损引起的,DNA合成导致无效的红细胞生成和细胞分裂的停滞。神经系统并发症,包括周围神经病,认知衰落和骨髓病,也很常见,这是由于髓磷脂合成和维持的破坏而引起的。总而言之,维生素B12对于维持DNA完整性,有效的细胞复制以及血液学和神经系统的整体健康是必不可少的。这种维生素的足够水平对于防止DNA损伤,支持适当的甲基化过程以及预防缺乏症的长期后果至关重要,包括贫血,神经变性和疾病易感性提高。
引文 Zhang ZY, Li X, Zhou XX, Zhang Y, Gan XP, Xu XM 和 Wu H (2023) 妊娠期高甘油三酯血症、糖尿病与血清铁蛋白的关系
妊娠期缺铁对孕产妇和胎儿的不良影响仍然是一个全球性的健康问题,影响着 10 - 90% 的孕妇 ( 1 ),因为铁是一种有害的补充剂。根据世界卫生组织的建议,每日口服补铁(每日摄入 30-60 毫克元素铁)应成为常规产前护理的一部分,以避免不良的孕产妇和胎儿结局,包括宫内生长受限、早产以及新生儿和围产期死亡 ( 1 ) ( 2 )。然而,当孕妇摄入过量的铁时,很容易对新生儿和母亲造成潜在的伤害,因为新兴研究表明,生命早期造血期间接触高铁可能会诱发贫血,对发育产生重大影响,并可能降低促红细胞生成素敏感性,从而限制红细胞生成 ( 3 ) ( 4 ) ( 5 )。血清铁蛋白是一种主要的铁储存蛋白,是广泛使用的全身铁储存标记物,具有纳米大小的水合氧化铁核心和笼状蛋白质外壳,含有 20% 的铁。最近越来越多的研究发现,血清铁蛋白浓度较高也与妊娠期代谢紊乱有关,如妊娠期糖尿病 (GDM)、血清脂类异常、胰岛素抵抗 (IR),胰岛素抵抗通过稳态模型评估-胰岛素抵抗 (HOMA-IR)、稳态模型评估-胰岛素分泌 (HOMA-IS) 和稳态模型评估-b 细胞功能 (HOMA-b) 等指标计算 (6)(7)(8)(9)。相反,还有其他相互矛盾的研究表明,补铁不会增加 GDM 的风险,但就妊娠结局而言对母亲和胎儿大有裨益 (10)(11)。考虑到研究的缺乏且结果相互矛盾,为了评估中国妊娠人群血清铁蛋白与代谢紊乱之间的关系,我们利用上海市第一人民医院孕妇的流行病学数据,探讨血清铁蛋白水平与妊娠期糖尿病、血脂异常、胰岛素抵抗等代谢紊乱患病率之间的关联。
社论
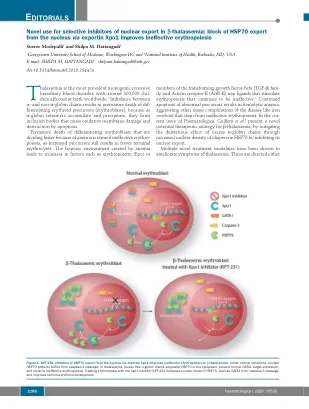
改善未结合的A -Globin和非A -Globin链之间的平衡或纠正无效的红细胞。修饰的TFG-β家族受体拮抗剂,如Sotatercemp(ACE-011)和Luspatercept(ACE-536)阻止配体与ACTR-II受体结合,并随后激活SMAD4信号通路,4改善Ery-Throid Throid Cell和红细胞的产生。通过CRISPR Therapeatics成功的基因疗法实现了未结合A -Globin与非A -Globin链的异常比例,并得到了波士顿顶点药物的支持。称为CTX001的体细胞疗法使用了编辑的患者自己的造血干细胞(HSC)来刺激胎儿血红蛋白的产生。5通过XPO1抑制HSP70的细胞内局部局部局部局部可能会合并这两个治疗目标。几条证据表明,红细胞使用分子伴侣在红细胞发育过程中对不稳定的过量A -Glo- bin链分割,6-8,因此,靶向这种伴侣的靶向时,当过量的globobin tetramer会累积时,靶向这种伴侣可能在β -tha -thaplamasemia中有用。许多组指出,分子伴侣HSP70在红细胞9-11中积聚至高水平,对于简化胚芽成熟很重要。11正常的人红细胞成熟需要在成熟后期的caspase-3瞬时激活,以防止过度的红细胞生产。激活的胱天蛋白酶可以切割GATA-1,从而导致成熟停滞和/或凋亡。12 Ribeil等。 14 GATA-1不再受到保护,导致末期成熟停滞和凋亡。12 Ribeil等。14 GATA-1不再受到保护,导致末期成熟停滞和凋亡。表明EPO会导致HSP70转移到核中,结合GATA-1并保护其免受caspase-3裂解。相反,在EPO剥夺期间,HSP70被排除在细胞核中,而GATA-1被cas-pase-3裂解,导致凋亡死亡。13因此,HSP70的细胞内位置的改变似乎在红细胞生存力中起关键作用(图1)。在β-丘脑贫血中观察到的无效性红细胞生成的特征是在多染色体阶段加速了红细胞分化,成熟停滞和凋亡。在人β-thal虫蛋白粒细胞的成熟过程中,HSP70直接通过过量的游离A-格珠蛋白链直接在细胞质中螯合(图1)。核定靶向的HSP70突变体或caspase-3-无分解的GATA-1突变体恢复了β-thal核阿无血成红细胞的终末成熟。14在Haematologica,Guillem等。3跟进这种机制,以表明导出蛋白1(XPO1)调节在正常条件下HSP70在红细胞中的HSP70的核质质位置。Guillem等。证实,用XPO1抑制剂KPT-251治疗红细胞增加了HSP70的核水平,从caspase-3裂解中救出了GATA1,并改善了末端红细胞原理(图1)。尽管使用核出口的选择性抑制剂(SINE)用于治疗淋巴瘤和多骨髓瘤