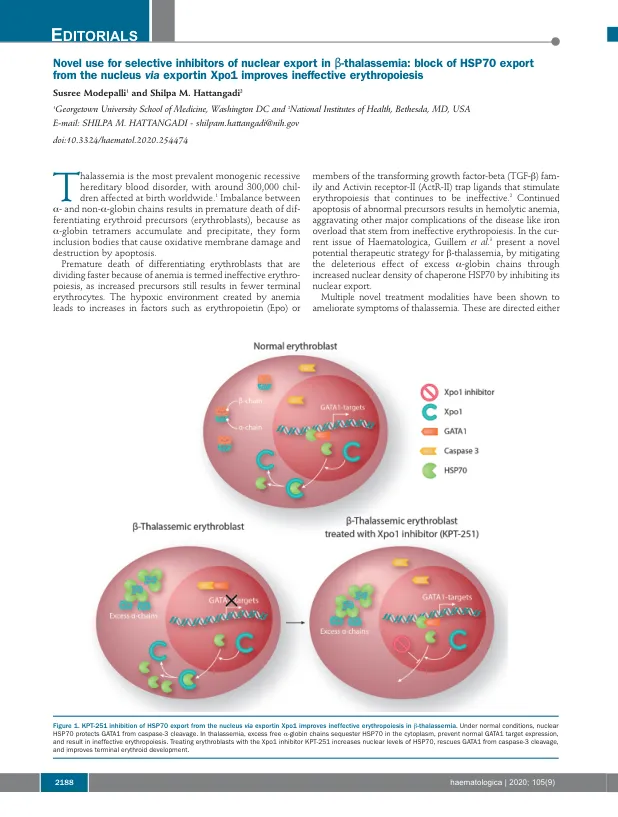
改善未结合的A -Globin和非A -Globin链之间的平衡或纠正无效的红细胞。修饰的TFG-β家族受体拮抗剂,如Sotatercemp(ACE-011)和Luspatercept(ACE-536)阻止配体与ACTR-II受体结合,并随后激活SMAD4信号通路,4改善Ery-Throid Throid Cell和红细胞的产生。通过CRISPR Therapeatics成功的基因疗法实现了未结合A -Globin与非A -Globin链的异常比例,并得到了波士顿顶点药物的支持。称为CTX001的体细胞疗法使用了编辑的患者自己的造血干细胞(HSC)来刺激胎儿血红蛋白的产生。5通过XPO1抑制HSP70的细胞内局部局部局部局部可能会合并这两个治疗目标。几条证据表明,红细胞使用分子伴侣在红细胞发育过程中对不稳定的过量A -Glo- bin链分割,6-8,因此,靶向这种伴侣的靶向时,当过量的globobin tetramer会累积时,靶向这种伴侣可能在β -tha -thaplamasemia中有用。许多组指出,分子伴侣HSP70在红细胞9-11中积聚至高水平,对于简化胚芽成熟很重要。11正常的人红细胞成熟需要在成熟后期的caspase-3瞬时激活,以防止过度的红细胞生产。激活的胱天蛋白酶可以切割GATA-1,从而导致成熟停滞和/或凋亡。12 Ribeil等。 14 GATA-1不再受到保护,导致末期成熟停滞和凋亡。12 Ribeil等。14 GATA-1不再受到保护,导致末期成熟停滞和凋亡。表明EPO会导致HSP70转移到核中,结合GATA-1并保护其免受caspase-3裂解。相反,在EPO剥夺期间,HSP70被排除在细胞核中,而GATA-1被cas-pase-3裂解,导致凋亡死亡。13因此,HSP70的细胞内位置的改变似乎在红细胞生存力中起关键作用(图1)。在β-丘脑贫血中观察到的无效性红细胞生成的特征是在多染色体阶段加速了红细胞分化,成熟停滞和凋亡。在人β-thal虫蛋白粒细胞的成熟过程中,HSP70直接通过过量的游离A-格珠蛋白链直接在细胞质中螯合(图1)。核定靶向的HSP70突变体或caspase-3-无分解的GATA-1突变体恢复了β-thal核阿无血成红细胞的终末成熟。14在Haematologica,Guillem等。3跟进这种机制,以表明导出蛋白1(XPO1)调节在正常条件下HSP70在红细胞中的HSP70的核质质位置。Guillem等。证实,用XPO1抑制剂KPT-251治疗红细胞增加了HSP70的核水平,从caspase-3裂解中救出了GATA1,并改善了末端红细胞原理(图1)。尽管使用核出口的选择性抑制剂(SINE)用于治疗淋巴瘤和多骨髓瘤
社论
主要关键词






















![社论。 ]军事事务](/simg/d/d88450039ed7dd87a6154f4578dda64949a8d08e.png)







