XiaoMi-AI文件搜索系统
World File Search Systemhomologous
对MCM8/9 Helicase Complex>的结构和机械见解
摘要MCM8和MCM9形成了一种功能性解旋酶复合物(MCM8/9),该复合酶在DNA同源重组修复中起着DNA双链断裂的作用。但是,DNA结合/放松的MCM8/9的结构表征尚不清楚。在这里,我们使用冷冻电子显微镜单粒子分析报告了MCM8/9复合物的结构。结构表明,MCM8/9通过三倍的对称轴排列到异己盒中,从而形成一个可容纳DNA的中央通道。MCM8/9的N-最小寡糖/寡核苷酸(OB)结构域的多种特征发夹突出进入中心通道,并放松双链DNA。被HROB激活时,MCM8/9的N层环的结构将其对称性从C3转换为C1,并通过扩展MCM8/9的Trimer界面的构象变化。此外,我们的结构动态分析表明,柔性C-Tier环相对于N层环表现出旋转运动,这是MCM8/9的放松能力所必需的。总而言之,我们的结构和生物化学研究为理解同源重组中MCM8/9解旋酶的DNA解体机制提供了基础。
生物物理学和分子生物学的进展
poly(ADP-核糖基)在维持基因组稳定性方面具有中心功能,包括促进DNA复制和修复。在癌细胞中,这些过程经常被破坏,因此干扰聚(ADP-核糖基)ation会加剧固有的基因组不稳定性并诱导选择性的细胞毒性。的确,基于同源重组的缺陷,聚(ADP-核糖)聚合酶(PARP)的抑制剂对治疗BRCA-突变卵巢癌的女性具有重大临床影响。然而,只有大约一半的卵巢癌在同源重组中存在缺陷,并且大多数敏感的肿瘤最终通过治疗获得了PARP抑制剂耐药性。因此,需要制定替代治疗策略,以靶向具有固有和获得抗性的PARP抑制的肿瘤。已经描述了多种新型聚(ADP-核糖)糖醇(PARG)的新型抑制剂,并在体外具有有希望的抗癌活性,与PARP抑制剂不同。在这里,我们讨论了聚(ADP-核糖基)在基因组稳定性中的作用,以及将PARG抑制剂作为PARP抑制剂治疗卵巢癌的互补策略的潜力。©2021 Elsevier Ltd.保留所有权利。
DNA 修复和植物线粒体基因组的稳定性
摘要:线粒体是细胞能量代谢的中心。它包含自己的基因组,即mtDNA,这是原核共生祖先的遗物。在植物中,线粒体的遗传信息影响重要的农学性状,包括生育力、植物活力、叶绿体功能和交叉兼容性。植物mtDNA具有显着的特征:它比其他真核生物的mtDNA大得多,并且结构进化非常迅速。这是因为重组活动会产生替代的mtDNA配置,这是促进mtDNA快速进化的重要遗传多样性库。另一方面,异位重组的高发生率导致mtDNA不稳定和基因嵌合体的表达,具有潜在的有害影响。与基因组的结构可塑性相反,在大多数植物物种中,mtDNA编码序列进化非常缓慢,即使基因组的组织高度可变。修复机制可能是造成如此低突变率的原因,特别是通过同源重组进行修复。本文我们回顾了植物细胞器基因组的一些特征以及在植物线粒体中发现的修复途径。我们进一步讨论了同源重组如何参与植物线粒体 DNA 的进化。
基于LPS去除的钩端螺旋体疫苗开发新策略
钩端螺旋体属的致病螺旋体是钩端螺旋体病的病原体。针对钩端螺旋体感染的细胞疫苗通常主要引起针对制剂中存在的血清型的 LPS 抗原的反应。没有合适的蛋白质候选物能够替代全细胞疫苗,因此需要新的疫苗开发方法来改善钩端螺旋体病的预防。我们的目标是开发一种基于 LPS 去除和蛋白质抗原暴露保护的独立于血清型的全细胞疫苗,以评估单价或双价疫苗对仓鼠同源和异源毒性钩端螺旋体的保护能力。钩端螺旋体经过热灭活,或用丁醇进行 LPS 提取,在某些情况下用甲醛进一步灭活。用同源或异源强毒血清型对仓鼠进行免疫和攻击,从幸存者身上采集血液和器官进行细菌定量、趋化因子评估,并通过蛋白质印迹分析血清抗体反应性和交叉反应性。用血清型 Copenhageni 或 Canicola 的热疫苗或低 LPS 疫苗免疫可使受到同源强毒细菌攻击的动物获得 100% 的保护。值得注意的是,与全细胞疫苗不同,用血清型 Canicola 生产的低 LPS 疫苗在受到强毒 Copenhageni 血清型的异源攻击时仅提供部分保护。用二价制剂免疫可使受到强毒血清型 Canicola 攻击的免疫动物获得 100% 的保护。生产的所有疫苗都能够消除受到攻击动物肾脏中的细菌。所有疫苗均能产生能够识别疫苗制剂中不存在的血清型抗原的抗体。所有免疫动物的 IFN γ、CXCL16、CCL5、CXCL10、CXCR6 和 CCR5 转录本均增加。结论:我们的结果表明,降低 LPS 的二价疫苗可能是一种针对异源性强毒血清型的有趣保护策略。除了理想的多价保护外,低 LPS 疫苗由于预期较低的致病性而特别有前景。
对 12 至 17 岁人群进行 COVID-19 疫苗加强剂安全性监测——美国,2021 年 12 月 9 日至 2022 年 2 月 20 日
截至 2022 年 2 月 20 日,美国仅批准将 BNT162b2(辉瑞-BioNTech)COVID-19 疫苗用于 12-17 岁人群 ( 1 )。美国食品药品监督管理局 (FDA) 于 2021 年 12 月 9 日修订了辉瑞-BioNTech 疫苗的紧急使用授权 (EUA),授权对 16-17 岁人群在接种第 2 剂后 ≥ 6 个月接种同源*加强剂 ( 1 )。2022 年 1 月 3 日,授权范围扩大到 12-15 岁人群,对于所有≥12 岁人群,第 2 剂与加强剂之间的间隔缩短至≥5 个月 ( 1 )。为了确定辉瑞-BioNTech 加强剂在 12-17 岁人群(青少年)中的安全性,CDC 审查了在接种同源辉瑞-BioNTech 加强剂后一周内向 v-safe 报告的不良事件和健康影响评估,v-safe 是一种基于智能手机的自愿性 COVID-19 疫苗接种后不良事件安全监测系统,以及向疫苗不良事件报告系统 (VAERS) 报告的不良事件,VAERS 是由 CDC 和 FDA 管理的被动疫苗安全监测系统。2021 年 12 月 9 日至 2022 年 2 月 20 日期间,约有 280 万美国青少年接种了辉瑞-BioNTech 加强剂。† 在此期间,向 v-safe 报告了 3,418 剂青少年接种辉瑞-BioNTech 加强剂的情况。接种加强剂后,报告的 v-safe 反应发生频率与接种第 2 剂后相同或略高,主要为轻度至中度反应,最常报告于接种疫苗后的第二天。VAERS 收到 914 份青少年接种辉瑞-BioNTech 加强剂疫苗后不良事件报告;837 份(91.6%)为非严重事件,77 份(8.4%)为严重事件。应告知医护人员、家长和青少年,青少年接种同源辉瑞-BioNTech 加强剂疫苗后可能会出现局部和全身反应,严重不良事件很少见。
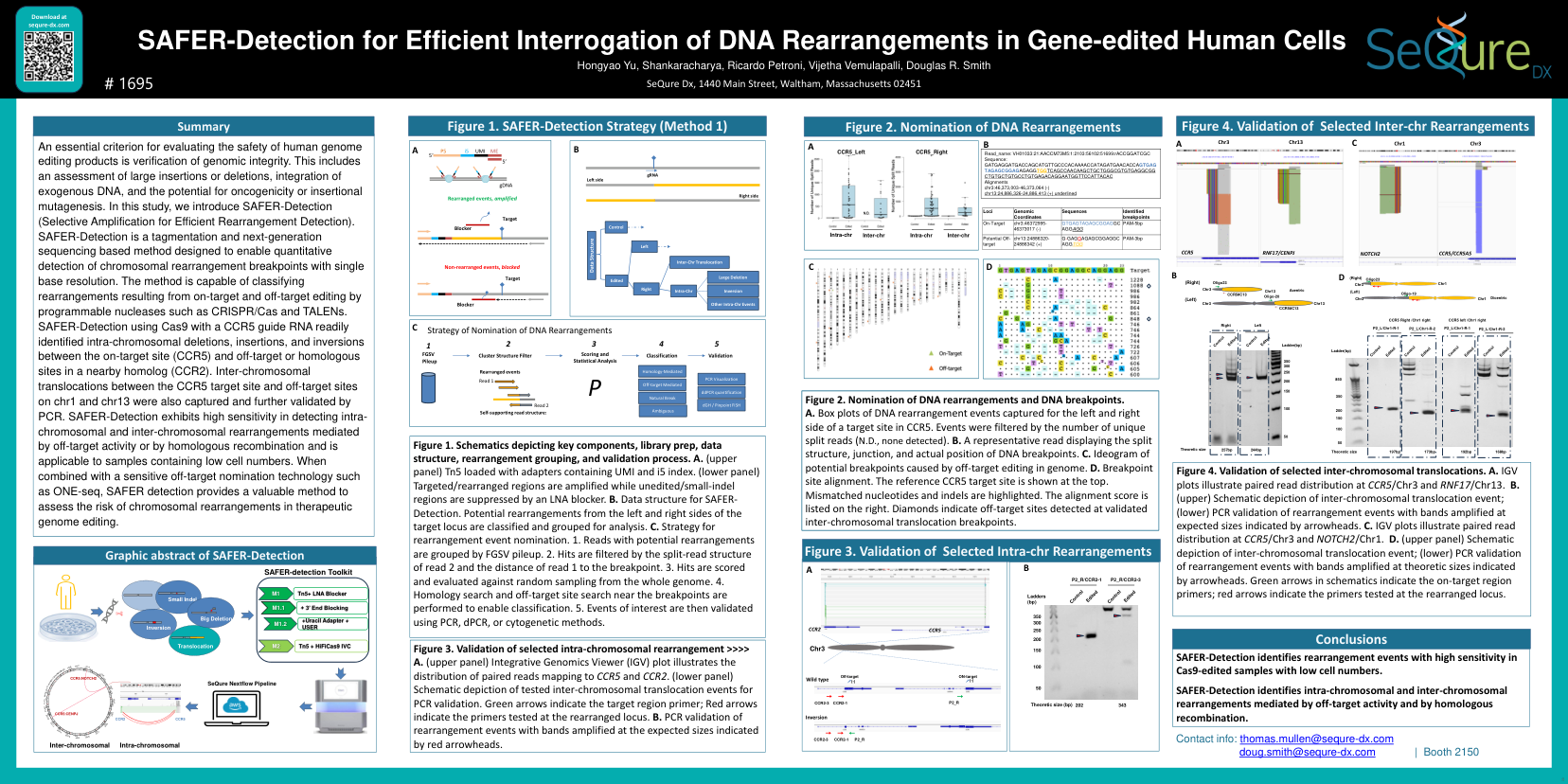
SAFER-Detection 用于有效检测基因编辑人类细胞中的 DNA 重排
评估人类基因组编辑产品安全性的一个重要标准是验证基因组完整性。这包括对大量插入或缺失、外源 DNA 整合以及致癌性或插入诱变可能性的评估。在本研究中,我们介绍了 SAFER-Detection(高效重排检测的选择性扩增)。SAFER-Detection 是一种基于标记和下一代测序的方法,旨在以单碱基分辨率定量检测染色体重排断点。该方法能够对由可编程核酸酶(如 CRISPR/Cas 和 TALEN)进行的靶向和脱靶编辑导致的重排进行分类。SAFER-Detection 使用 Cas9 和 CCR5 向导 RNA,可轻松识别靶位点 (CCR5) 与附近同源物 (CCR2) 中的脱靶或同源位点之间的染色体内缺失、插入和倒位。CCR5 靶位点与 chr1 和 chr13 上的脱靶位点之间的染色体间易位也被捕获并通过 PCR 进一步验证。SAFER-Detection 在检测由脱靶活动或同源重组介导的染色体内和染色体间重排方面表现出高灵敏度,适用于含有低细胞数的样本。当与灵敏的脱靶提名技术(如 ONE-seq)结合使用时,SAFER 检测提供了一种评估治疗性基因组编辑中染色体重排风险的宝贵方法。
RADA和DNA聚合酶在重组中的作用 - ... 对甲基甲基蛋白抗甲氧西林和甲氧西林敏感的金黄色葡萄球菌ST398菌株的基因组分析 氯化的双苯基转化,过氧化物酶和氧化酶活性的真菌和细菌从历史污染部位分离出来 在28nm n-mosfets中,氧化物分解事件的位置专用于RF应用程序 hi-ness:基于细菌核苷相关蛋白的遗传编码的DNA标记家族
摘要:在生命的三个领域中,同源重组(HR)的过程在修复双链DNA断裂和重新开始停滞的复制叉中起着核心作用。奇怪的是,参与人力资源过程的主要蛋白质参与者似乎对于高素化的古细菌提出了有关人力资源在极端条件下的古细菌中的复制和修复策略中的作用的有趣问题。该过程的一个关键参与者是重组酶RADA,它允许同源链搜索,并提供了遵循DNA合成并恢复遗传信息所需的DNA底物。DNA聚合酶在古细菌中尚不清楚链交换步骤后的操作。使用Abyssi Abyssi蛋白的工作,在这里我们表明,DNA聚合酶,家庭-B聚合酶(POLB)和家族-D聚合酶(POLD)都可以负责处理RADA介导的重组中间体。我们的结果还表明,与POLB相比,POLD的效果要少得多,以扩展位移环(D-Loop)底物处的入侵DNA。这些观察结果与先前对热圆菌物种获得的遗传分析相吻合,表明POLB主要参与DNA修复,而不是必不可少的,这可能是因为Pold可以接管其他伴侣。
crispr-cas的引入及其在植物中的应用
Li 等人。利用引导 RNA 和 Cas9 在拟南芥和本氏烟中进行多重和同源重组介导的基因组编辑。《自然生物技术》31:688-691。Shan 等人。利用 CRISPR-Cas 系统对作物进行靶向基因组修饰。《自然生物技术》31:686-688。Nekrasov 等人。利用 Cas9 引导的核酸内切酶在模型植物本氏烟中进行靶向诱变。《自然生物技术》31:691-693。
有关FDA为加速细胞和基因疗法进步的努力的更新
再生医学套件最终指南文件1。21 CFR 1271.15(b)下的同一外科手术程序例外:有关例外范围的问题和答案2。对人类细胞,组织以及细胞和组织产物的调节考虑:最小的操纵和同源使用(2020年7月更新)3。评估与再生医学的设备高级疗法4。为严重疾病的再生医学疗法加急计划
酵母中DNA双链断裂周围的染色质景观及其对DNA修复途径选择的影响
摘要:DNA双链断裂(DSB)是有害的DNA病变,如果无法正确修复,这会对基因组稳定性产生灾难性后果。dsb可以通过非同源末端连接(NHEJ)或同源重组(HR)来修复。这两种途径之间的选择取决于哪种蛋白质结合到DSB末端以及如何调节其作用。nhej启动了KU复合物与DNA末端的结合,而HR是由5'触发的DNA链的核解度降解引发的,这需要几种DNA核酸酶/解旋酶并产生单链DNA悬垂。dsb修复发生在精确组织的染色质环境中,其中DNA围绕组蛋白八聚体形成核小体。核 - 躯体对DNA末端加工和修复机械施加了障碍。修改DSB周围的染色质组织可以通过去除整个核小体的去除,这要么通过染色质重塑因子的作用,或者是通过染色质重塑因子的作用,或者通过染色体后的转换修改来允许进行正确的DSB修复,从而可以增加染色质的功能,从而增加修复enzymes对DNA的可及性。在这里,我们回顾了酵母酿酒酵母中DSB周围发生的翻译后修饰及其在DSB修复中的作用,并特别注意DSB修复途径选择。