XiaoMi-AI文件搜索系统
World File Search Systemixekizumab
COVID-19 疫苗接种常见问题解答
o 阿达木单抗、赛妥珠单抗、依那西普、戈利木单抗、英夫利昔单抗、 o 沙利木单抗、托珠单抗 o 阿巴西普 o 阿普斯特 o 伊克珠单抗、苏金单抗 o 乌司他单抗 o 阿那白滞素 o 贝利木单抗 o 利妥昔单抗 JAK 抑制剂:巴拉替尼、托法替尼、乌帕替尼、非戈替尼 由于该疫苗不是活疫苗,因此如果您正在服用上述药物,则可以接种该疫苗。服用这些药物时,您对疫苗的反应可能会减弱。因此,您应该继续遵循政府关于降低感染风险的指导。最近接种过利妥昔单抗(也称为 Truxima、Rixathon、MabThera)的人可能不太可能对 COVID-19 疫苗产生免疫反应。这意味着,如果您在接种疫苗前 6 个月或接种疫苗后 4 周内使用过利妥昔单抗,疫苗的效果可能会降低。但是,如果您最近使用过利妥昔单抗,接种疫苗仍然是安全的,并且可能会从中受益。对于接受利妥昔单抗的风湿病患者,我们建议在前 2 剂疫苗接种时注意以下事项:
HIM.PA.SP60 生物和非生物 DMARD
修订日志请参阅本政策末尾的重要提醒,了解重要的监管和法律信息。描述以下是需要事先授权的生物学和非生物学疾病改良的抗毛药(DMARD):tocilizumab(actemra®),adalimumab(humira®),adalimimAb-abab-afzb(abrilada™) P(Hulio®),Adalimumab-Adaz(Hyrimoz®),Adalimumab-aacf(idacio®),adalimumab-ryvk(ymlandi®b-a),adalimumab ry™),英澳,secukinumab(cosentyx®),eTanercept(enbrel®),vedolizumab(entyasstekinizum®mab-srlf(imuldosa™),infrifiximab-dyyb(fiffectra® Ab-Mrkz(Omvohteil®),Umab-aauz(Otulfi®),Ustekinumab-ttwe(Pyzchiva®),英夫利昔单抗(Remicade®),英夫利克斯莫比(Remicade®) N(Simponi®,SimponiAria®),risankizumab-rzaa(Skyrizi®),Deucravacitinib(Sotyktu™),uStekinumab(stelara®),ustekinumab-stba(seqeyma®®®)® ®),Natalizumab-sztn(Tyruko®),Natalizumab(Tysabri®),Etrasimod(Velsipity™),Ustekinumab-auub(Wezlana™),Tofacitinib-rjankinib-rjank®U®,Xeljanz™),Xeljanz™),OzAniMod(Zepos)(Zepos)(Zepos)。 FDA 批准适应症
白塞氏综合征的新观点和未来观点
摘要 白塞氏综合征是一种多变性血管炎,其特征是多种临床表现,由涉及多个器官和系统的炎症引起。虽然在了解白塞氏综合征的发病机制和治疗方面已经取得了重大进展,但在实现最佳疾病控制和预防长期并发症方面仍然存在挑战。本综述探讨了白塞氏综合征治疗的最新进展,重点关注新兴疗法和未来发展方向。阿普斯特是一种磷酸二酯酶 4 抑制剂,在治疗粘膜皮肤表现,特别是口腔溃疡方面显示出良好的前景。托珠单抗是一种白介素 (IL)-6 受体抑制剂,已证明对某些患者群体有效,特别是那些有眼部受累的患者。然而,它在血管性白塞氏综合征中的使用需要仔细考虑。在托珠单抗治疗期间,口腔和生殖器溃疡复发可能很棘手。其他新兴疗法,如 IL-17 抑制剂(包括 secukinumab 和 ixekizumab)、IL-12/23 抑制剂 ustekinumab 和 Janus 激酶 (JAK) 抑制剂(包括 tofacitinib 和 baricitinib),正在研究其针对特定炎症通路的潜力。未来的研究方向包括开发新的治疗靶点、通过确定可从中受益的患者群体来更好地利用现有药物、开发更好的疾病评估工具以及针对目标的治疗方法,以改善白塞氏综合征患者的治疗结果和生活质量。
脓疱性银屑病:病理生理学和治疗方案的最新进展叙述
治疗方案。目前的治疗通常基于标准斑块性银屑病的现有疗法。然而,对于脓疱性银屑病,仍然需要具有高疗效、持续性和快速起效的治疗方法。最近对脓疱性银屑病发病机制的了解取得了进展,为潜在的治疗方法提供了见解。脓疱性银屑病的治疗通常取决于疾病的程度和严重程度,近年来,包括生物疗法在内的新药物的使用越来越多。目前,美国食品药品管理局和欧洲药品管理局已批准在美国(及其他国家)治疗中度至重度斑块状银屑病的生物疗法包括肿瘤坏死因子 α 抑制剂(阿达木单抗、赛妥珠单抗、依那西普、英夫利昔单抗)、白细胞介素 (IL)-17 抑制剂(brodalumab、ixekizumab、secukinumab)、IL-12/23 抑制剂(ustekinumab)和 IL-23 抑制剂(guselkumab、risankizumab、tildrakizumab)。最近,IL-36 通路的特定抑制剂已在 GPP 和 PPP 中得到评估,包括 IL-36 受体抑制剂 spesolimab,该药物已在 GPP 中显示出良好的效果。治疗脓疱性银屑病的新兴药物提供了快速有效治疗的可能性,而且毒性比现有疗法更低。进一步研究作用于 IL-36 通路的药物和其他靶向疗法有可能改变未来
组合化学免疫疗法的疗效是针对HER2改变的晚期非小细胞肺癌患者的一线治疗:病例系列
结果:总共报告了388例主要可疑IL-17抑制剂相关的胃肠道事件(268个IBD和120个结肠炎),其中包括348例涉及secukinumab(sec)的病例,涉及涉及ixekizumab(ixe)的36例,涉及涉及brodalumab(ixe)的病例。在SEC和IXE中观察到IBD总事件的统计学上的报告率(ROR = 2.13,95%CI [1.96-2.30]和ROR = 2.79,95%CI [2.39-3.27]),而BRO并未触发安全信号。29项研究,其中包括34例病例,显示了IBD的证据,紧随SEC(79.4%)和IXE(20.6%)治疗。中位年龄为42岁;典型的初始症状包括腹泻(90.9%),腹痛(57.6%),血腥腹泻(51.5%)和发烧(36.4%)。IBD症状发作的中位时间为2.9个月。某些情况伴随着升高的白细胞(WBC)计数(87.5%),红细胞沉降率(ESR; 85.7%),C反应蛋白(CRP; 100%)和粪便CALProtectin(FC; 100%)。戒断IL-17抑制剂加上皮质类固醇和TNF拮抗剂的治疗,无论是单一疗法还是组合,都可能导致完全的临床缓解。 IL-17抑制剂中断后的缓解时间中位时间为4周。戒断IL-17抑制剂加上皮质类固醇和TNF拮抗剂的治疗,无论是单一疗法还是组合,都可能导致完全的临床缓解。IL-17抑制剂中断后的缓解时间中位时间为4周。
国家首选、高性能和基本处方集的炎症疾病首选专科管理政策 - 选择/替代
o Actemra ® (托珠单抗皮下注射剂 – 基因泰克/罗氏) o Tyenne ® (托珠单抗-aazg 皮下注射剂 – Fresenius Kabi) • Kevzara ® (sarilumab 皮下注射剂 – Regeneron) 白介素 17 阻滞剂 • Bimzelx ® (bimekizumab 皮下注射剂 – UCB) • Cosentyx ® (苏金单抗皮下注射剂 – 诺华) • Siliq ®(brodalumab 皮下注射剂 – Valeant) • Taltz ®(ixekizumab 皮下注射剂 – Eli Lilly) Interleukin-23 阻滞剂 • Ilumya ®(tildrakizumab-asmn 皮下注射剂 – Sun/Merck) • Omvoh ®(mirakizumab-mrkz 皮下注射剂 – Eli Lilly) • Skyrizi ® (risankizumab-rzaa 皮下注射剂 – AbbVie)• Tremfya ®(guselkumab 皮下注射剂 – Janssen/Johnson & Johnson)白介素 12/23 阻滞剂• Stelara ®(ustekinumab 皮下注射剂 – Janssen Biotech/Johnson & Johnson)白介素-1 阻滞剂• Kineret ®(anakinra 皮下注射剂 – Swedish Orphan Biovitrim)T 细胞共刺激调节剂• Orencia ®(abatacept 皮下注射剂 − Bristol Myers Squibb)整合素受体拮抗剂• Entyvio ®(vedolizumab 皮下注射剂 – Takeda)Janus 激酶抑制剂• Olumiant ®(baricitinib 片剂 – Eli Lilly)• Rinvoq ®(upadacitinib 缓释片剂 – AbbVie)• Rinvoq ® LQ(乌帕替尼口服溶液 - AbbVie)• Xeljanz ®(托法替尼片,托法替尼口服溶液 - 辉瑞)• Xeljanz ® XR(托法替尼缓释片 - 辉瑞)4 型磷酸二酯酶抑制剂• Otezla ®(阿普斯特片 - 安进)鞘氨醇 1-磷酸受体调节剂• Velsipity ™(依曲莫德片 - 辉瑞)• Zeposia ®(奥扎尼莫德胶囊 - 新基)酪氨酸激酶 2 抑制剂• Sotyktu ™(德克拉伐替尼片 - 百时美施贵宝)
与生物学以及口服JAK或TYK2抑制剂的结合使用顽固的牛皮癣和银屑病关节炎:病例系列
患者2-皮肤缓解和MDA是在一个加载剂量+一种维持剂量的Guselkumab后实现的。仅在upadacitinib治疗中继续患者,Guselkumab是D/C'ED。Patient 5—Prior to starting dual deucravacitinib+ixekizumab therapy, this patient had been trialled on combination deucravacitinib 6 mg QD+guselkumab 100 mg/mL (treatment trialled for 84 days and then d/c'ed due to cutaneous failure) and combination upadacitinib 15 mg QD+ixekizumab 80 mg/mL (led to skin 70天后的缓解和MDA总共治疗259天,此时患者患有支气管炎,D/C'ED联合疗法,直到支气管炎得到改善)。最近,该患者正在接受DEU+IXE组合疗法,但是,该患者在缓解218天后经历了PSO耀斑,并切换到Bimekizumab。*PSO和PSA持续存在,或者从PSO/PSA对这种药物的观点均失去了功效。†PSO持续存在或从PSO上丧失了这种药物的疗效。‡其他不良事件经历。§PSA持续存在或从PSA的角度丧失了这种药物的功效。¶不知所措或保险是由以前的提供商处方的,或由于缺乏保险范围而停产。bim,bimekizumab; Brod,Brodalumab; BSA,身体表面积; d/c'ed,停产; deuc,deucravacitinib; F,女; ixe,ixekizumab; M,男性; MDA,最小疾病活动;单一疗法; PSA,银屑病关节炎; PSO,牛皮癣; QD,每天; SX,症状; UPA,Upadacitinib。
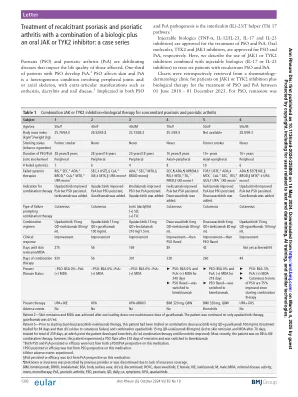
ard-2024-225534.full.pdf
抽象目标是获得有关银屑病关节炎(PSA)药理治疗功效和安全性的最新证据的概述。方法,这种系统文献研究(SLR)研究了常规合成(CS),生物学(B)和靶向合成(TS)疾病改良抗疾病药物(DMARDS)的功效和安全性。使用Medline,Embase,Cochrane Central进行了系统的数据库搜索,以确定自2019年上一次更新至2022年12月28日以来发表的相关文章。功效,同时还考虑了有关安全观察数据的功效。特别感兴趣的不良事件是感染(包括带状疱疹,流感和结核病),恶性肿瘤,主要不良心血管事件,静脉血栓栓塞,肝病,实验室变化和精神病学不良事件。未进行荟萃分析。有效性结果,分析了3946篇文章,分析了38篇文章(30篇试验)。所研究的化合物包括CSDMARDS(Leflunomide,甲氨蝶呤),BDMARDS抑制IL17(Bimekizumab,Brodalumab,ixekizumab,Izokibibep,Izokibep,izokibep,secukinumab,secukinumab,IL-23)以及TNF(Adalimumab,certolizumab-pegol,etanercept,英夫利昔单抗,Golimumab)和Janus激酶抑制剂(Jaki)(Brepocitinib,deucravacitinib,tofacitinib,tofacitinib,upadacitinib)。所研究的化合物在改善PSA的体征和症状,改善身体功能和生活质量方面有效。安全指标通常与2019年的先前SLR相干。为了安全性,筛选了2055篇摘要,并分析了24篇文章:15项观察性研究和9次长期随访,评估糖皮质激素,TNFI,IL-17I,JAKI,JAKI,IL-12/23I和PDE4I(APREMILAST)。结论该SLR的结果告知了负责2023年更新的工作组
轴向脊椎关节炎患者的工作生产力引发了生物学或靶向合成疾病改良的抗疾病药物:系统文献综述和荟萃分析
抽象背景轴向脊柱炎(AXSPA)可以限制工作参与。我们的目标是表征AXSPA患者的生产力,包括在用生物学和靶向合成疾病改良的抗疾病药物(B/ TSDMARDS)治疗12-16周后发生变化。方法,一项系统文献综述确定了2010年1月1日至2021年10月21日发表的研究,该研究使用了启动B/TSDMARDS的AXSPA患者的工作效率和活动障碍(WPAI)问卷报告工作效率(WPAI)问卷。基线和第12-16周的总体工作生产力,旷工,表现主义和活动障碍评分用于随机效应荟萃分析,以计算每个WPAI域域的基线的绝对平均变化。包括接受安慰剂(n = 727)的AXSPA患者的11项研究或接受Adalimumab,Bimekizumab,Etanercept,ixekizumab,secukinumab或Tofacitinib(n = 994)的治疗的结果。在启动B/TSDMARD的有效患者中,平均基线总体工作生产力障碍,缺勤和演讲主义评分分别为52.1%(n = 7个研究),11.0%和48.8%(n = 6个研究)。在第12-16周,B/TSDMARDS或安慰剂总体工作障碍的基线的汇总平均变化为-21.6%和-12.3%。将结果推算至1年后,每名患者的有偿生产率损失的年度降低范围为11 962.88欧元至14 293.54欧元。有超过50%的活跃AXSPA患者的结论主要归因于主持人主义。对于接受B/ TSDMARD的患者而言,总体工作生产率在第12-16周的提高了。工作生产率损失与大量成本负担相关,这会随着减值的改善而减少。
系统文献研究通知2023 UPD
抽象目标是获得有关银屑病关节炎(PSA)药理治疗功效和安全性的最新证据的概述。方法,这种系统文献研究(SLR)研究了常规合成(CS),生物学(B)和靶向合成(TS)疾病改良抗疾病药物(DMARDS)的功效和安全性。使用Medline,Embase,Cochrane Central进行了系统的数据库搜索,以确定自2019年上一次更新至2022年12月28日以来发表的相关文章。功效,同时还考虑了有关安全观察数据的功效。特别感兴趣的不良事件是感染(包括带状疱疹,流感和结核病),恶性肿瘤,主要不良心血管事件,静脉血栓栓塞,肝病,实验室变化和精神病学不良事件。未进行荟萃分析。有效性结果,分析了3946篇文章,分析了38篇文章(30篇试验)。所研究的化合物包括CSDMARDS(Leflunomide,甲氨蝶呤),BDMARDS抑制IL17(Bimekizumab,Brodalumab,ixekizumab,Izokibibep,Izokibep,izokibep,secukinumab,secukinumab,IL-23)以及TNF(Adalimumab,certolizumab-pegol,etanercept,英夫利昔单抗,Golimumab)和Janus激酶抑制剂(Jaki)(Brepocitinib,deucravacitinib,tofacitinib,tofacitinib,upadacitinib)。所研究的化合物在改善PSA的体征和症状,改善身体功能和生活质量方面有效。安全指标通常与2019年的先前SLR相干。为了安全性,筛选了2055篇摘要,并分析了24篇文章:15项观察性研究和9次长期随访,评估糖皮质激素,TNFI,IL-17I,JAKI,JAKI,IL-12/23I和PDE4I(APREMILAST)。结论该SLR的结果告知了负责2023年更新的工作组