XiaoMi-AI文件搜索系统
World File Search System载他莫昔芬的 L-赖氨酸包覆磁性氧化铁纳米粒子对乳腺癌细胞周期阻滞和抗癌活性的高效性
摘要 简介:由于药物的副作用,纳米级药物递送系统的发展带来了药物治疗的显著改善,因为药物的药代动力学发生了变化,毒性降低,药物的半衰期增加。本研究旨在合成载有他莫昔芬 (TMX) 的 L-赖氨酸包覆磁性氧化铁纳米粒子作为纳米载体,以研究其对 MCF-7 癌细胞的细胞毒性和抗癌特性。方法:合成磁性 Fe 3 O 4 纳米粒子并用 L-赖氨酸 (F-Lys NPs) 包覆。然后,将 TMX 负载到这些 NP 上。通过 X 射线衍射 (XRD)、傅里叶变换红外光谱 (FTIR)、扫描电子显微镜 (SEM)、透射电子显微镜 (TEM)、动态光散射 (DLS)、差示扫描量热法 (DSC)、振动样品磁强计 (VSM) 和热重分析 (TGA) 评估合成纳米粒子 (F-Lys-TMX NPs) 的特性。在 pH 5.8 和 pH 7.4 下分析药物释放。将 MCF-7 细胞暴露于 F-Lys-TMX NPs、F-Lys NPs 和 TMX 24、48 和 72 小时。为了评估设计的纳米粒子的细胞毒潜力,进行了 MTT 和细胞凋亡测定、实时 PCR 和细胞周期分析。结果:F-Lys-TMX NPs 具有球形形态,尺寸范围为 9 至 30 nm。通过增加纳米粒子浓度和处理时间,与 TMX 相比,在 F-Lys-TMX NPs 处理的细胞中观察到更多的细胞增殖抑制和凋亡诱导。ERBB2、细胞周期蛋白 D1 和细胞周期蛋白 E 基因的表达水平下调,而 caspase-3 和 caspase-9 基因的表达水平上调。药物释放研究表明,纳米粒子的释放缓慢且受控,受 pH 依赖。细胞周期分析表明,F-Lys-TMX NPs 可以将细胞停滞在 G0/G1 期。结论:研究结果表明,与 TMX 相比,F-Lys-TMX NPs 更有效,并且具有抑制细胞增殖和诱导凋亡的潜力。因此,F-Lys-TMX NPs 可被视为针对 MCF-7 乳腺癌细胞的抗癌剂。
自噬的成人发作导致突触稳态和认知障碍的丧失,
摘要越来越多的研究将大噬菌/自噬的功能障碍与阿尔茨海默氏病(AD)等疾病的发病机理联系起来。鉴于自噬对体内平衡的全球重要性,其功能障碍如何导致特定的神经系统变化令人困惑。为了进一步研究这一点,我们使用ATG7 IKO比较了成年小鼠自噬的全局失活,并与AD相关的致病性变化在突触蛋白的自噬处理中的影响。孤立的前脑突触体,而不是来自ATG7 IKO小鼠的总匀浆,表现出突触蛋白的积累,这表明突触可能是蛋白质稳态破坏的脆弱部位。此外,自噬的停用导致随着时间的推移会导致认知表现受损,而大型运动技能仍然完好无损。尽管自噬停用了6.5周,但在没有细胞死亡或突触丧失的情况下,认知的变化是。在AD的症状应用PSEN1 PSEN1双转基因小鼠模型中,我们发现自噬体成熟的障碍与从这些小鼠分离的自噬体中离散的突触蛋白的存在减少,从而导致这些蛋白质中的一种在洗涤剂无效的蛋白质蛋白质中积累。该蛋白质,SLC17A7/VGLUT,也积聚在ATG7 IKO小鼠突触体中。综上所述,我们得出结论,突触自噬在主要促进蛋白稳态中起作用,并且在降低自噬会中断正常的认知功能的同时,运动的保存表明并非所有电路都受到类似的影响。我们的数据表明,AD中自噬活性的破坏可能与这种成人发作神经退行性疾病的认知障碍有关。缩写:2Drawm:2天径向臂水迷宫;广告:阿尔茨海默氏病; Aβ:淀粉样蛋白β; AIF1/IBA1:同种异体移植炎症因子1;应用:淀粉样蛋白β前体蛋白; ATG7:自噬相关7; AV:自噬液泡; CCV:货物捕获价值; CTRL:控制; DLG4/PSD-95:光盘大型Maguk支架蛋白4; GFAP:神经胶质原纤维酸性蛋白; grin2b/nmdar2b:谷氨酸离子型热带受体NMDA型亚基2B;有限公司:长期抑郁症; MAP1LC3/LC3:微管相关蛋白1轻型链3; m/o:几个月大; PNS:核后上清液; PSEN1/PS1:Presenilin 1; SHB:蔗糖均质化缓冲液; SLC32A1/VGAT:Solute Carrier家族32成员1; SLC17A7/VGLUT1:Solute Carrier家族17成员7; SNAP25:突触体相关蛋白25; SQSTM1/p62:隔离1; Syn1:Synapsin I; SYP:突触素; SYT1:Synaptotagmin 1;塔姆:他莫昔芬; VAMP2:囊泡相关的膜蛋白2; VCL:Vinculin; WKS:几周。
kisqali®(ribociclib) - 步骤疗法 - UnitedHealthcare商业计划
步骤治疗计划用于鼓励某些治疗类别使用较低的成本替代方案。该程序要求成员尝试两种依赖Cyclin依赖性激酶(CDK)4和6抑制剂,然后为Kisqali® /kisqali®Femara®Femara®共包覆盖激素受体(HR) - 阳性,阳性,人表皮生长因子2(HER2)(HER2)术语术语或Metatastics-Metastatics-Metastatics-Metastatics-Metastatics cancer。kisqali®(Ribociclib)是一种激酶抑制剂,该激酶抑制剂可用于治疗成人激素受体(HR) - 阳性,人类表皮生长因子受体2(HER2) - 阴性晚期或转移性癌症,将芳香酶抑制剂作为初始内分泌疗法或Fasterantion therapy或Fastrane疗法(均为植物)(flasecrine therapy)(Fulvaseanter)(flasector)(Fulvasect)®(Fullvasector)(Fulvase)(Fulvase)(Fulvase)®内分泌疗法。kisqali与芳香酶抑制剂结合使用,用于辅助治疗激素受体(HR)阳性的,人类表皮生长因子受体2(HER2)生长因子受体2(HER2) - 阴性II期和III期早期乳腺癌早期乳腺癌,并以高复发的高风险。国家综合癌症网络(NCCN)建议使用基斯加利人使用Kisqali,同样对于患有不可切除的(局部或区域)或转移性激素受体(HR)阳性HER2阴性乳腺癌的男性。ibrance®(palbociclib)是一种激酶抑制剂,用于治疗成年患者HR-阳性HER2阴性晚期或转移性乳腺癌与芳香酶抑制剂作为初始内分泌疗法,或与Faslodex®(Faslodex®(Faslodex®(Faslodex®(Faslodex®))结合使用,在接受疾病进展的患者中,将其作为初始的基于内分泌的疗法。NCCN建议使用反复切除(局部或区域)或转移性HR- HR-阳性HER2阴性乳腺癌疾病的男性使用Ibrance。verzenio®(Abemaciclib)是一种激酶抑制剂,用于治疗成年患者HR阳性,HER2阴性晚期或转移性乳腺癌与芳香酶抑制剂作为初始内分泌疗法的结合,与Faslodex®(FASLODESTAITS)结合使用HRR-PROSSISTIATS,是基于内分泌的芳香酶抑制剂,与HR-prosister for hers 2-Norty sertistation Her 2-相结合。内分泌疗法,作为对成年患者在转移性环境中内分泌治疗和先前化学疗法后的HR阳性,HER2阴性晚期或转移性乳腺癌的治疗,以及内分泌疗法(内分泌疗法或芳族氧化氨基法或芳香族酶抑制剂)的成年人受体患者(HRORMASE抑制剂)的糖尿病患者(HR) - HR) - HR-HR-HRENMONES患者 - HR-HR) - (HER2) - 阴性,淋巴结阳性,早期乳腺癌,复发风险很高。NCCN建议使用verzenio使用Verzenio,同样对于反复出现的不可切除(局部或区域)或转移性HR阳性HER2阴性乳腺癌疾病的男性。
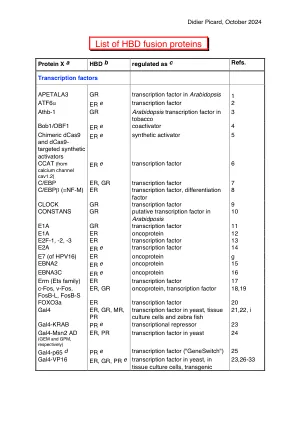
HBD 融合蛋白列表 - Picard 实验室 |
Picard, D. (2000)。通过与类固醇结合域融合实现蛋白质的翻译后调控。Methods Enzymol. 327 , 385-401。ER α HBD 融合在小鼠中的应用:Whitfield, J.、Littlewood, T.、Evan, GI 和 Soucek, L. (2015)。小鼠模型中的雌激素受体融合系统:可逆转换。Cold Spring Harb. Protoc. 2015 , 227-234。参考文献 1. Sablowski, RW 和 Meyerowitz, EM NO APICAL MERISTEM 的同源物是花同源基因 APETALA3/PISTILLATA 的直接靶标。Cell 92 , 93- 103 (1998)。 2. Thuerauf, DJ, Marcinko, M., Belmont, PJ 和 Glembotski, CC ATF6α 和 ATF6β 异构体特异性特征对内质网应激反应基因表达和细胞活力的影响。J. Biol. Chem. 282, 22865-22878 (2007)。3. Aoyama, T. 等人。拟南芥转录激活因子 Athb- 1 的异位表达改变了烟草叶细胞的命运。Plant Cell 7, 1773-1785 (1995)。4. Laumen, H., Nielsen, PJ 和 Wirth, T. BOB.1/OBF.1 辅激活因子对 B 细胞中八聚体依赖性转录至关重要。Eur. J. Immunol. 30, 458-469 (2000)。 5. Lu, J. 等人。用于转录激活和基因组编辑的多模式药物诱导 CRISPR/Cas9 装置。核酸研究。46,e25(2018)。6. Gomez-Ospina, N.、Tsuruta, F.、Barreto-Chang, O.、Hu, L. 和 Dolmetsch, R. L 型电压门控钙通道 ca(v)1.2 的 C 端编码转录因子。细胞 127,591-606(2006)。7. Umek, RM、Friedman, AD 和 McKnight, SL CCAAT 增强子结合蛋白:分化开关的组成部分。科学 251,288-292(1991)。 8. Müller, C., Kowenz-Leutz, E., Grieser-Ade, S., Graf, T. & Leutz, A. NF-M(鸡 C/EBP beta)诱导造血祖细胞系嗜酸性分化和凋亡。EMBO J. 14 , 6127-6135 (1995)。9. McDonald, MJ & Rosbash, M. 果蝇昼夜节律基因表达的微阵列分析和组织。Cell 107 , 567-578 (2001)。10. Simon, R., Igeno, MI & Coupland, G. 拟南芥花分生组织身份基因的激活。Nature 384 , 59-62 (1996)。 11. Picard, D., Salser, SJ & Yamamoto, KR 糖皮质激素受体类固醇结合域内可移动且可调节的失活功能。Cell 54 , 1073-1080 (1988)。12. Spitkovsky, D. 等人。腺病毒 E1A 在具有 E1A 依赖性条件性增殖的细胞系中对细胞周期蛋白基因表达的调节。J. Virol. 68 , 2206-2214 (1994)。13. Vigo, E. 等人。CDC25A 磷酸酶是 E2F 的靶标,是 E2F 有效诱导的 S 期所必需的。Mol. Cell. Biol. 19 , 6379-6395 (1999)。 14.Jones, ME, Kondo, M. & Zhuang, Y. A tamoxifen inducible knock-in allele for investigation of E2A function. BMC Dev. Biol. 9 , 51 (2009). 15.Zhao, B. et al. RNAs induced by Epstein-Barr virus Nuclear Antigen 2 in Lymphoblastoid cell lines. Proc. Natl. Acad. Sci. USA 103 , 1900-1905 (2006). 16. Maruo,S. 等人。Epstein–Barr 病毒核蛋白 EBNA3C 是淋巴母细胞细胞周期进程和生长维持所必需的。美国国家科学院院刊 103,19500-19505(2006 年)。
ribociclib 联合氟维司群对晚期乳腺癌治疗总生存期的影响 — 最新 MONALEESA-3 结果
用于治疗ER+/HER2-乳腺癌患者的药物包括abemaciclib、palbociclib和ribociclib。Ribociclib是一种高选择性CDK4/6抑制剂,临床前研究表明其对实体瘤(包括ER+/HER2-晚期乳腺癌)有高活性[9]。人体体外和体内研究表明,它在肝脏中代谢(主要通过CYP3A4)。Ribociclib及其代谢物主要经粪便排泄,少量经肾脏排泄。已进行了三项III期研究,旨在确认ribociclib在治疗晚期乳腺癌患者中的有效性。第一项是III期MONALEESA-2研究,患者为激素依赖型HER2阴性晚期乳腺癌患者,由于病情进展,这些患者此前未接受过全身治疗[10]。该研究招募了 668 名患者,随机分配接受ribociclib联合来曲唑治疗或来曲唑单药治疗。主要终点是无进展生存期,ribociclib 组的无进展生存期明显更长;18 个月 PFS 率为 63% [95% CI (置信区间) 54.6–70.3],安慰剂组为 42.2%,95% CI 为 34.8–49.5,安慰剂组的中位 PFS 为 14.7 个月(95% CI 13.0–16.5)(实验组中位 OS 未达到)。在更新的分析中,经过中位 26.4 个月的随访,实验组的中位 PFS 为 25.3 个月,对照组为 16 个月,风险比 (HR) 为 0.568; 95% CI 0.457–0.704;p = 9.63 × 10 –8 [11]。研究表明,作为次要终点的总生存期 (OS) 有所改善。在 2021 年欧洲肿瘤内科学会 (ESMO) 大会上,研究人员展示了最新的研究结果,结果显示联合治疗组的 OS 有所延长;中位数分别为 63.9 个月 vs. 51.4 个月 (HR 0.76;95% CI 0.63–0.93;p = 0.004) [12]。这是一项出色的观察结果,表明晚期乳腺癌患者可以存活 5 年以上。另一方面,MONALEESA-7 研究是第一项使用 CDK4/6 抑制剂的 III 期研究,仅招募绝经前或围绝经期患者 [13]。该研究纳入了 672 名患者,他们可接受激素治疗或化疗作为新疗法或辅助疗法,以及一线化疗治疗晚期疾病。患者接受瑞博西尼与他莫昔芬或芳香化酶抑制剂(来曲唑或阿那曲唑)和戈舍瑞林联合治疗,或对照组单独接受激素治疗。主要终点是 PFS,瑞博西尼组的中位 PFS 为 23.8 个月,而安慰剂组为 13 个月(HR 0.55;95% CI 0.44–0.69;p < 0.0001)。MONALEESA-7 研究中关于将瑞博西尼添加到激素治疗中的首批数据显示,与激素治疗相比,OS 显著增加
在9个月内,医院废水中细胞抑制剂的多目标分析
癌症是全球最致命的疾病之一,其inci dence每年都在增加。在欧洲,这种疾病约有20%的总死亡人数,每年约300万例新病例和170万例死亡[46]。在葡萄牙,在2020年证实了60,467例新的癌症病例,结肠癌癌症是发病率最高的癌症,其次是乳腺癌和前列腺癌IARC [26]。为了治疗这种疾病,可以使用许多程序:手术,化学疗法,放射治疗,靶向治疗,免疫疗法,干细胞/骨髓移植和激素治疗。最好的治疗方法是根据癌症的类型/阶段和治疗的可用性选择。其中,化学疗法是第二次应用的治疗方法[1]。化学疗法包括使用药物杀死癌细胞。这些药物,称为细胞抑制剂,抗癌药或细胞毒素(解剖学治疗化学分类的L类,即可以以口服形式(大部分时间在家,经常去医院去医院)或静脉注射形式(通常在医院或医疗保健设施进行)[36]。尽管它们在癌症的治疗方面非常有效,但细胞抑制剂也会影响健康的组织,尤其是在快速复制的情况下,例如血细胞,皮肤细胞,胃细胞等。根据国际癌症研究机构[27],一些细胞抑制剂已经被确定为人类的致癌,例如依托泊苷,环磷酰胺,他莫昔芬,硫唑啉,硫硫氨酸,硫磺蛋白,布鲁芬和氯腹co。其他人,阿霉素,顺铂,达卡巴嗪和mitoxan trone已被归类为可能或可能对人类致癌。仍然,由于缺乏毒理学研究,大多数细胞抑制剂尚未分类。给药后,人体无法代谢所有药物,其中一部分是通过尿液和粪便排出的。因此,细胞抑制剂以及其他药物,细菌和病毒都经常从医院释放到水循环系统。在全球范围内,有一些医院已经拥有废水处理厂(WWTP),可在将废水排放到城市下水道中之前提供局部消除微污染物[31,41]。有时,这些治疗方法还不足以去除最顽固的药物,而大多数全球医院都没有用于废水的补救技术。The main objective of this study is to evaluate the presence of thir teen pharmaceuticals of concern (bicalutamide, capecitabine, cyclo phosphamide, cyproterone, doxorubicin, etoposide, flutamide, ifosfamide, megestrol, mycophenolate mofetil, mycophenolic acid, paclitaxel and prednisone) in Portuguese hospital在9个月的活动中,废水总共包括一百二十九个样本。固相提取(SPE)和液相色谱 - 串联质谱法(LC - MS/MS)分别用于提取和定量目标细胞抑制剂。直到au thors的知识,这是第一次在全世界的医院废水中监测氟丁酰胺,霉菌酸酯和霉酚酸。葡萄牙细胞抑制剂水平的数据很少,只有一项关于从北部城市WWTP的Portu Guese废水监测的研究的研究[24]。仍然,完全缺乏有关葡萄牙医院废水的细胞抑制剂发生的信息
线粒体在肠肠细胞饮食脂质加工中的作用
肠上皮由一层柱状上皮细胞组成,该细胞在养分吸收和代谢的调节中履行重要功能,并在腔膜的腔微生物群和免疫细胞之间形成结构性屏障。线粒体主要以它们在能量产生中的功能而闻名,但也参与了许多细胞过程(包括代谢,免疫和应激反应)的调节。线粒体功能障碍与衰老和稳定增长的人类疾病有关。有影响线粒体功能的突变患者通常会出现多种胃肠道症状,例如剧烈的体重减轻,肠道衰竭和伪阻断,以及与营养不良相关的严重腹部疼痛。线粒体在肠道中的功能,尤其是在肠中运输和分泌脂质时,仍然鲜为人知。为了检查线粒体在肠道中的作用,我们创建了用肠上皮细胞(IEZ)特定的Dars2的小鼠,这些小鼠被称为dars2 iez-ko小鼠。dars2是一种线粒体特异性的asparyl-tRNA合酶,可促进13 mtDNA编码的Oxphos亚基的线粒体翻译。缺乏DARS2最终导致呼吸链功能障碍非常明显。连续五天连续五天对他莫昔芬进行给药,导致dars2在成人2 fl/fl villin-creer t2小鼠(dars2 tamiez-ko小鼠)的IEZ中消融。dars2 iez -ko小鼠出生于预期的孟德尔疾病,但出现了自发的表型后产后,该表型以严重的体重减轻,低血糖和繁荣的疾病来表达。对这些小鼠的肠道组织的组织学检查导致了受干扰的组织结构,这与上皮干细胞的损害,增殖和分化以及大脂质滴中脂质的大量积累有关。令人惊讶的是,只有近端小肠的肠细胞才能在dars2 tamiez -ko小鼠中散落在包括脂肪在内的食物中的营养物质的有效吸收,动员和运输,含有大脂肪(Lipid Plostlet,LD,LD)。此外,具有IEZ特异性消融的小鼠琥珀酸脱氢酶(SDHA)是电子传输链CII的一部分,也是TCA循环的酶,以及cytrome C-氧化酶组装因子HEM A:纤维群Transylesyltansyltansylansylansylansfrassefase(Coceryltransferase)Is One One OneS110 IS,一率, IEZS中使用CIV的组装因子。sdha iez -ko和cox10 iez -ko小鼠均显示出与dars2 iez -ko小鼠相似的表型。这些小鼠的体重显着降低,无法在四个星期的时间内生存,并且在肠细胞中显示出大量的LD富集。综上所述,这些发现表明缺乏线粒体会导致肠肠细胞中LD的积累,这表明线粒体功能的丧失会损害食物脂肪的运输。肠细胞记录的数字脂质是重生的,并由甘油三酸酯脂蛋白组成,尤其是以酪蛋白(CM)的形式组成,然后将其释放到血液中,以便为外围器官提供脂质。有趣的是,以无脂肪的饮食喂养可以防止dars2 tamiez -ko小鼠的肠球细胞中LDS的脂肪累积,这表明
反义寡核苷酸的强大世界:从实验室到临床
对生物机制的理解使得开发第一种靶向疗法成为可能。这些疗法最初针对的是导致疾病或与疾病特别相关的蛋白质。对 ER 在乳腺癌中的作用的理解以及对其阻断机制的识别推动了针对所谓“激素依赖性”乳腺癌(ER 阳性、雌激素受体阳性)的激素疗法的开发。他莫昔芬现在是 ER 阳性乳腺癌的标准治疗方法。它通过竞争性抑制雌二醇与其受体的结合起作用(Jordan,2003 年)。针对特定表位的单克隆抗体也构成了一类非常重要的靶向疗法。它们彻底改变了哮喘等炎症性疾病的治疗(Pelaia 等人,2017 年)。然而,对导致疾病的基因变异的识别为使用靶向疗法提供了主要动力。例如,相互易位t(9; 22),即费城染色体,是慢性粒细胞白血病 (CML) 的标志。因此,t(9;22) 易位最先用于确诊 CML (Heisterkamp 等,1990 年;Rowley,1973 年)。这种易位会产生异常的融合基因 (BCR-ABL)。由此产生的 BCR-ABL 融合蛋白由于其组成性酪氨酸激酶活性而具有致癌特性 (Lugo、Pendergast、Muller 和 Witte,1990 年)。与蛋白激酶催化位点结合的 ATP 竞争性抑制剂的开发导致了一种特异性疗法:伊马替尼或 Gleevec ®,从而彻底改变了 CML 和其他疾病的治疗方式 (Kantarjian 和 Talpaz,2001 年)。同样,致癌 NTRK(神经营养性原肌球蛋白相关激酶)融合基因的鉴定最近导致了特异性抑制剂(larotrectinib 或 Vitrakvi ®、entrectinib 或 Rozlytrek ®)的开发,用于治疗成人和儿童的 NTRK 阳性癌症(Cocco、Scaltriti & Drilon,2018 年)。在肿瘤学中,针对复发性点突变的特异性抑制剂也得到了广泛开发(Martini、Vecchione、Siena、Tejpar & Bardelli,2012 年;Skoulidis & Heymach,2019 年)。在某些情况下,会产生很少或根本不产生蛋白质。胰岛素就是这种情况,胰岛素依赖型糖尿病(I 型)患者缺乏这种酶。患者接受胰岛素疗法治疗,通过施用替代蛋白质来忠实重现胰岛素生理分泌的效果。 1982 年,第一种人类胰岛素蛋白上市,开创了一种新模式:可以修改激素蛋白的序列,使其药代动力学特性与患者的生理需求相匹配(McCall & Farhy,2013 年)。除了这些“蛋白质特异性”疗法外,还开发了针对 DNA(脱氧核糖核酸)的方法。至于蛋白质,最初的治疗尝试是基于对 DNA 的整体改变,例如通过使用烷化剂。这些药物会诱导非特异性共价键的产生,从而产生 DNA 加合物。它们会破坏复制和转录,这解释了它们在癌症治疗中的用途(Noll、Mason 和 Miller,2006 年)。插入也是小平面分子与 DNA 的一种特殊结合模式。它们会改变 DNA 的构象,破坏 DNA 和 RNA 聚合酶的活性(Binaschi、Zunino 和 Capranico,1995 年)。靶向 DNA 的分子并不局限于肿瘤学应用。例如,甲氨蝶呤是一种在细胞周期 S 期抑制核酸合成的抗代谢物,它已经取代了传统上使用的银盐用于治疗类风湿性关节炎(Browning、Rice、Lee 和 Baker,1947 年)。除了这些以非特异性方式与 DNA 相互作用的分子之外,人们还设想了针对性策略,以纠正导致疾病的有害基因。这种方法被称为基因疗法(Kaufmann、Büning、Galy、Schambach 和 Grez,2013 年)。一个非常有前景的例子(正在申请上市许可 [MA])涉及治疗 β 地中海贫血症,这是一种血红蛋白遗传性疾病。在这里,患者的干细胞被分离并被改造以替换有害基因,这样它们就可以产生正常的血红蛋白。然后将改造后的细胞注射回患者体内(Cavazzana-Calvo 等人,2010 年;Thompson 等人,2018 年)。这些令人惊叹的方法可以用于治疗许多疾病,包括糖尿病,尽管它们的实施非常复杂。最后,长期以来被认为是简单中间分子的 mRNA 最近已成为感兴趣的治疗靶点。 mRNA 是精细转录和转录后调控的位点,与许多疾病有关。因此,近年来 RNA 分子也受到关注,因为这些分子与蛋白质和 DNA 一样,是开发靶向疗法的候选分子(Disney、Dwyer 和 Childs-Dis-ney,2018 年)。第一种反义寡核苷酸 (ASO) 就是在这种背景下出现的。ASO 是单链合成 RNA 或 DNA 分子,平均长度为 12 至 25 个核苷酸。它们的序列与其靶标的序列互补,以确保特异性。因此,ASO 的序列由其靶标的序列决定。此外,这些分子可以定位在细胞质和细胞核中,从而可以到达细胞质和/或细胞核靶标(参见 Potaczek、Garn、Unger 和 Renz,2016 年的综述)。 ASO 经过化学改性,免受核酸酶的作用(否则会降解它们),并允许它们穿过质膜而无需矢量化。根据这些变化,ASO 可分为三代(如下所述)(图 1)。ASO 的化学性质很重要,因为它决定了其作用方式(降解目标 RNA 或掩盖位点而不降解)。因此,ASO 可以进行广泛的调节,