XiaoMi-AI文件搜索系统
World File Search System10320 Camino Santa Fe,Suite G San Diego,CA 92121 TEL
功能细胞因子主要由活化的T淋巴细胞以及肥大细胞和成骨细胞分泌,这些细胞和成骨细胞控制造血祖细胞的产生和分化为谱系受限细胞。还刺激成熟的嗜碱性粒细胞,嗜酸性粒细胞和单核细胞在功能上激活。此外,在神经细胞增殖和存活中起着重要作用。也参与了骨稳态,并通过防止NF-kappa-b核易位和激活抑制破骨细胞的分化(PubMed: 341841841834475从机械上讲,通过由IL3RA亚基和转导亚基IL3RB的信号(通过相似性)组成的受体发挥其生物学作用。受体刺激导致JAK2激酶活性的快速激活导致STAT5介导的转录程序。另外,通过激活由PI3K/AKT和ERK介导的途径(通过相似性)介导的途径,从而有助于细胞存活。
与动力蛋白相关的光感受器蛋白防止睫状适应蓝光
已知通过调节动力蛋白进行睫状运动的光响应性调节,但该机理尚未完全了解。在这里,我们报告了一个两头f/i1内臂动力蛋白的新型亚基,名为Dyblup,在动物精子中,单细胞绿色藻类。该亚基包含一个BLUF(使用FAD的蓝光传感器)域,该结构域似乎会直接调节Dynein活性,以响应光。Dyblup(Div>与Dynein相关的BLUF蛋白)介导了F/I1运动结构域与将电动机与Doublet微管联系起来的系带络合物之间的连接。缺乏染色的直系同源物的衣原体既表现出阳性和负面光,但是被适应并吸引了高强度的蓝光。这些结果表明,通过直接照相染料素来避免有毒的强光。
计算蛋白设计和蛋白质结构预测
图1。蛋白质结构的层次结构。主要:由DNA碱基三重态的相应序列确定的氨基酸序列。次要:形成α-螺旋和β-片的常规几何模式。第三纪:多肽链的详细3D形状。第四纪:几个多肽链或亚基的关联。
鉴定生物标志物和黑色素瘤的靶向药物
在Chi等人发表的文章中,将MERS-COV S1亚基的序列注入了人CD4的跨膜结构域(TM)和RABV G蛋白的细胞质结构域(CD)。将单个转录单元插入RABV(SRV9菌株)cDNA克隆中,用于营救嵌合RABV,RSRV9-MERS S1,将融合片段S1 -TM-CD插入了RABV(SRV9菌株)cDNA克隆。透射电子显微镜表明,使用反向遗传学成功救出了活病毒。间接免疫荧光测定法证明了S1亚基被表达并转运到细胞表面。随后,收集了RSRV9 -MERS S1库存,被B-丙二醇酮灭活,然后在不连续的蔗糖梯度上通过超速离心纯化。进一步,Chi等。使用三种不同的动物进行体内测试:小鼠,骆驼和羊驼。小鼠的测试表明
SLC30A8 基因座的多种遗传变异影响局部超级增强子活性并影响胰腺 β 细胞的存活和功能
缩写:3C,染色体构象捕获;4C,环状染色体构象捕获;ATAC-seq,使用测序检测转座酶可及染色质;Cas9,来自化脓性链球菌的内切酶;CHIP-seq,染色质免疫沉淀和 DNA 测序;CRISPR,成簇的规律间隔的短回文重复序列;CTCF,CCCTC 结合因子;EXT1,外骨化素糖基转移酶 1;GSIS,葡萄糖刺激的胰岛素分泌;GWAS,全基因组关联研究;MED30,RNA 聚合酶 II 转录亚基 30 的介质;pcHi-C,启动子捕获 Hi-C;R,调控区;RAD21,双链断裂修复蛋白 rad21 同源物;SLC30A8,溶质载体家族 30 成员 8;SNP,单核苷酸多态性; T2D,2 型糖尿病;TAD,拓扑关联结构域;UTP23,UTP23 小亚基加工体成分。
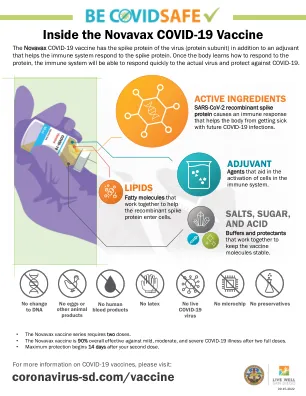
Novavax COVID-19 疫苗内部
Novavax COVID-19 疫苗含有病毒的刺突蛋白(蛋白质亚基),以及帮助免疫系统对刺突蛋白作出反应的佐剂。一旦人体学会如何对蛋白质作出反应,免疫系统将能够快速对实际病毒作出反应并预防 COVID-19。
L05:海洋微生物共生
首先使用针对小亚基(SSU)核糖体RNA(rRNA)基因的多样性调查获得对“谁在那里”的了解后,这些微生物体经常被整体或较小的单位进行检查,以理解细胞的功能,与动物的性质,并最终对动物的影响,并洞察微生不动的角色<
自然科学 div>
摘要:谷胱甘肽S-转移酶(GST)是参与动物排毒过程的必不可少的酶。它们催化抗氧化剂谷胱甘肽(GSH)的偶联到各种亲电的化合物,例如环境毒素,致癌物和代谢副产品,形成胃酸,这些苏联酸是水溶性更大的,可以被排除。此过程可保护细胞免受氧化应激和化学损害的影响,而在肝,肾脏和肺等排毒器官中,GST尤其丰富。除解毒外,GST还调节了信号转导,凋亡和细胞增殖等细胞过程。GST从兔肝脏中纯化,产量为22倍,产量为78-80%。使用1-氯-2,4-二硝基苯作为底物评估酶活性,导致91 µmole/min/mg/mg蛋白的特定活性。凝胶过滤,以揭示酶的天然分子量约为50,000。聚丙烯酰胺凝胶电泳(SDS-PAGE)来检查酶的亚基组成,并使用染色体来确定其等电点(PI)。来自兔肝脏的纯化GST酶表现出两个不同的亚基,分子量为28,000和27,000,所有酶活性与天然聚丙烯酰胺凝胶电泳中的单个蛋白质带有关。该酶在6.5左右显示出最佳的pH值,并受热的影响最小,在室温下存储八天后,保留了50%的活动。酶与1,2-氧基-3-(硝基苯氧基)丙烷和乙酰乙酸等底物的谷胱甘肽降低显示较高的共轭速率。染色体将GST分解为七个同工酶,PI值范围为7.96至9.6。主要同工酶(PI 8.6)负责超过94%的整体活性,并由两个半相同的亚基组成。该研究成功纯化和表征了兔肝GST,揭示了其亚基组成,等电点和底物特异性。研究结果表明,兔肝脏包含具有相似免疫学特性的多种同工酶,主要同工酶负责大多数酶活性。这种纯化和表征提供了对动物组织中GSTS的酶特性和功能多样性的见解。各种抑制剂和兔肝脏的底物活性的作用进行了测试。
通过转录组分析对TFIIE调节的基因表征
1。引言转录是将DNA段复制到真核生物中的RNA中的多步过程,直接在形成一个称为预发起络合物(PIC)的重要中间体(Engel等,2018)之前。PIC的组装需要募集RNA聚合酶II(RNAP II),介体复合物和六个通用转录因子(GTFS:TFIIA,TFIIB,TFIIB,TFIID,TFIII,TFIIE,TFIIF和TFIIH)这些因素中的许多因素已经在原核生物和真核生物中进行了很好的研究和表征(Matsui等,1980)。在GTFS中,GTF2E虽然不如其他特征,但对于转录函数非常重要。GTF2E由两个亚基GTF2E1和GTF2E2组成。GTF2E1是较大的亚基,分子量为56 kDa,而GTF2E2较小,分子质量为34 kDa(Peterson等,1991)。gtf2e1对于转录启动至关重要,gtf2e2的活性完全取决于
脂肪溶液和长链脂肪酸生物合成基因的表达分析,饲喂分级脂质水平
癌症是对人类健康和生命的威胁。尽管以前以化学药物治疗为中心,但癌症治疗已进入了精确的靶向治疗时代。有针对性的治疗需要精确的指导,从而选择性地杀死癌细胞,从而减少对健康组织的损害。因此,探索肿瘤治疗的潜在靶标的需求至关重要。依赖细胞周期蛋白的激酶调节亚基1B(CKS1B)是保守的细胞周期蛋白激酶亚基1(CKS1)蛋白家族的成员,在细胞循环中起着至关重要的作用。大量研究表明,CKS1B与许多人类癌症的发病机理有关,并且与耐药性密切相关。在这里,我们描述了当前对CKS1B细胞功能及其潜在机制的理解,总结了CKS1B作为癌症治疗靶点的最新研究,并讨论CKS1B作为治疗靶点的潜力。