XiaoMi-AI文件搜索系统
World File Search SystemCD300A的阻滞增强了人类NK细胞裂解血液系统恶性肿瘤的能力
摘要目的:分化的人类簇(CD)300A,一种具有免疫受体酪氨酸抑制序列的I型跨膜蛋白,被研究为靶向血液学恶性肿瘤(HMS)的人类天然杀伤(NK)细胞的潜在免疫检查点。方法:我们实施了一个涉及CD300A配体磷脂酰丝氨酸(PS)的刺激系统,暴露于恶性细胞的外表面。此外,我们利用CD300A过表达,CD300A阻止系统和异种移植模型来评估CD300A对NK细胞在体外和体内环境中对HMS的影响。此外,我们探索了患者CD300A与HM进展之间的关联。结果:我们的发现表明PS会阻碍NK细胞的功能。增加的CD300A表达抑制了NK细胞的HM裂解。CD300A的过表达通过损害移植的NK细胞来缩短HM-XENORGARGED小鼠的存活。用抗体阻断PS – CD300A信号显着放大了NK细胞中裂解功能相关蛋白和效应细胞因子的表达,从而增强了裂解HMS的能力。在临床上,CD300A表达的增强与HMS或实体瘤患者的肿瘤内NK细胞的“疲劳”表型相关。结论:这些结果提出了CD300A作为对HMS基于NK细胞的治疗的潜在目标。关键字NK单元格; CD300A;磷脂酰丝氨酸;免疫检查点;血液系统恶性肿瘤
8-N,家庭和社区豁免
▪ 脑恶性肿瘤,大脑 ▪ 脑恶性肿瘤,额叶 ▪ 脑恶性肿瘤,颞叶 ▪ 脑恶性肿瘤,顶叶 ▪ 脑恶性肿瘤,枕叶 ▪ 脑恶性肿瘤,心室 ▪ 脑恶性肿瘤,小脑 ▪ 脑恶性肿瘤,脑干 ▪ 脑恶性肿瘤,中脑,脑脚或延髓恶性肿瘤 ▪ 脑恶性肿瘤,脑膜 ▪ 脑恶性肿瘤,脑神经 ▪ 脑继发性恶性肿瘤 ▪ 神经系统其他部分继发性恶性肿瘤,脑膜 ▪ 脑和神经系统其他部分良性肿瘤,脑 ▪ 脑和神经系统其他部分良性肿瘤,脑神经 ▪脑和神经系统其他部位的良性肿瘤、脑膜 ▪ 脑炎、脊髓炎或脑脊髓炎 ▪ 颅内或脊髓内脓肿 ▪ 缺氧性脑损伤 ▪ 蛛网膜下腔出血 ▪ 脑内出血 ▪ 其他和未特指的颅内出血 ▪ 脑前动脉闭塞和狭窄 ▪ 脑动脉闭塞 ▪ 短暂性脑缺血 ▪ 急性但定义不明确的脑血管病
2023 LIN年度报告_2023.3.29
是装备的。 div>三个Artichetles WU在2023年发表在Peer-Review Journal中B. Wu和A. J. J. J.B. Kayira(2023)。 div> 冠状病毒疾病2019(Covid-19)再感染率:可质性的工具,用于指导疫苗优先级和插入政策;疫苗(巴塞尔)11(7)。 div> Warlest,M。R.,A。Jordan,R。Wu。 G. Kalua,G。Kalua,G。(2023)。 div> 六个月的生存率和危险因素的生存和风险因素因不属不属不良的不良因素而在不良元素中发生恶性肿瘤的毒素性亚菌素症中的抗霉菌症trughceneing trughceneing在恶性肿瘤中恶属不良的不良元素中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性产生了不良状态。 div> Herman,J.,E。Robins,A。Smadiime,A。Dushime,E。Rwaghose,BFSagiro,S。Gumbo,C。 Wu,S。Joseph,Q。Duke,N。Addage和R. Wadgedara(2023)。 div> 使用创新方法击中卫生系统重置COUBID-19-大流行:所选共同核算的案例研究在公共卫生中计数fronnntiers 11. div>B. Kayira(2023)。 div>冠状病毒疾病2019(Covid-19)再感染率:可质性的工具,用于指导疫苗优先级和插入政策;疫苗(巴塞尔)11(7)。 div>Warlest,M。R.,A。Jordan,R。Wu。 G. Kalua,G。Kalua,G。(2023)。 div>六个月的生存率和危险因素的生存和风险因素因不属不属不良的不良因素而在不良元素中发生恶性肿瘤的毒素性亚菌素症中的抗霉菌症trughceneing trughceneing在恶性肿瘤中恶属不良的不良元素中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性产生了不良状态。 div> Herman,J.,E。Robins,A。Smadiime,A。Dushime,E。Rwaghose,BFSagiro,S。Gumbo,C。 Wu,S。Joseph,Q。Duke,N。Addage和R. Wadgedara(2023)。 div> 使用创新方法击中卫生系统重置COUBID-19-大流行:所选共同核算的案例研究在公共卫生中计数fronnntiers 11. div>六个月的生存率和危险因素的生存和风险因素因不属不属不良的不良因素而在不良元素中发生恶性肿瘤的毒素性亚菌素症中的抗霉菌症trughceneing trughceneing在恶性肿瘤中恶属不良的不良元素中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性肿瘤中的恶性产生了不良状态。 div>Herman,J.,E。Robins,A。Smadiime,A。Dushime,E。Rwaghose,BFSagiro,S。Gumbo,C。 Wu,S。Joseph,Q。Duke,N。Addage和R. Wadgedara(2023)。 div>使用创新方法击中卫生系统重置COUBID-19-大流行:所选共同核算的案例研究在公共卫生中计数fronnntiers 11. div>
2024; 15(9): 2627-2645. doi: 10.7150/jca.91131 综述 妇科恶性肿瘤中的葡萄糖代谢重编程
由于肥胖、病毒感染、不良生活习惯以及社会经济压力等因素,妇科肿瘤的发病率和死亡率呈逐年上升趋势,已成为女性健康的重大威胁。大量研究表明,肿瘤细胞在糖酵解中具有显著的代谢活性,并能通过特定机制影响肿瘤的恶性生物学行为。因此,了解糖酵解蛋白、调控分子和信号通路在肿瘤发生、发展和治疗中的作用对患者和妇科医生至关重要。本文旨在综述糖代谢异常与宫颈癌、子宫内膜癌、卵巢癌等妇科肿瘤的相关性,为妇科肿瘤的早期筛查、及时诊断和治疗干预提供有价值的科学依据,并有助于预防妇科肿瘤患者的复发。
现实世界中第三种 COVID-19 疫苗在血液系统恶性肿瘤患者中的剂量和抗体反应
结果 493 名参与者中,274 名 (55.6%) 在 3V 前和 3V 后血清阳性 (+/+),115 名 (23.3%) 在第三剂后从之前的阴性血清转为阳性 (-/+)。其余 104 名 (21.1%) 在 3V 之前和之后均为血清阴性 (-/-)。没有参与者在 3V 前血清阳性而在 3V 后血清阴性 (+/-)。结果显示,接种第三剂 COVID-19 疫苗后,血清阳性比例显着增加 (P<0.00001)。对 3V 的反应与 3V 疫苗类型 (P=0.0006)、先前的 COVID-19 感染 (P=0.0453) 和恶性肿瘤诊断 (P<0.0001) 显着相关。与淋巴细胞白血病患者相比,多发性骨髓瘤或相关疾病患者 3V 后血清转化 (-/+) 的可能性更高 (优势比:8.22,95% CI:2.12–31.79;P=0.0008)。
靶向RNA测序的表演,用于分析血液恶性肿瘤中融合转录,基因突变和表达的表达
然而,诸如全基因组测序,转座酶访问的染色质 - 序列或RNA测序(RNA-SEQ)之类的技术暴发可能通过在编码区域外部编码区外的基因组改变区域,分别为3个表面签名,4,5和Gene Cresessional cressions profiles。6在这项研究中,我们选择评估RNA-seq的诊断值,因为该技术允许探索3个遗传信息:基因序列,基因融合和基因表达。有趣的是,这些不同级别的分析都带来了有关肿瘤细胞的独立信息,因此,它们的整合应完善诊断的精度。For example, acute myeloid leukemia (AML) patients prognosis is evaluated by cytogenetics (copy number abnormalities and struc- tural variants), further refined by the analysis of the mutational status of a few genes, and could maybe be improved by transcrip- tomic signatures such as the 17-gene leukemia stem cell score (LSC17) which is a proxy of the number of leukemic stem细胞。已经描述了7种不同的RNA-seq库制备技术,从而可以分析样品的所有RNA分子,或者使用富集步骤来靶向感兴趣的基因,例如Messenger RNA或小RNA物种。值得注意的是,图书馆准备的选择应优化感兴趣的目标数量和所需的测序深度之间的平衡,以便在常规环境中保持经济负担。迄今为止,大多数涉及癌症的基因已经通过整个外显子组测序的大型程序来识别。迄今为止,大多数涉及癌症的基因已经通过整个外显子组测序的大型程序来识别。8基于这些考虑因素,我们决定评估涉及癌症生物学的1385个基因的靶向RNA-seq面板的性能。我们在这里介绍了靶向RNA-Seq检测融合转录本的分析性能,以鉴定与临床相关实体相关的转录曲线,并检测血液恶性肿瘤中临床意义的复发突变。
嵌合抗原受体T细胞疗法在血液学恶性肿瘤治疗中的作用:优势,试验和磨难,ROA
免疫疗法是癌症治疗的即将到来的趋势。传统的癌症治疗方法包括手术切除,放疗,化学疗法,小分子靶向药物,单克隆抗体和造血干细胞移植(HSCT)。手术切除术对早期患者有用,但对转移性癌细胞不起作用。放疗和化学疗法更为普遍,但会对正常组织造成重大损害,选择性差。靶向药物,包括单克隆抗体,具有更好的综合功效,但也可以鼓励肿瘤细胞和药物耐受性的基因突变。HSCT是有效的,但是选择捐赠者通常很难,而移植物也容易被排斥。因此,嵌合抗原受体(CAR)-T细胞疗法是一种细胞/收养免疫疗法的一种形式,由于其持续缓解,副作用较少和更好的生活质量,因此处于癌症治疗的最前沿。CAR-T细胞疗法涉及基因修饰T细胞并繁殖其数量以杀死癌细胞。本评论文章洞悉了CAR-T细胞如何从具有适度的免疫功能的简单T细胞演变为基因设计的强大对应物,这在治疗血液学恶性肿瘤方面带来了巨大的希望。在过去的十年中,已经进行了许多研究,以设计和传递CAR-T细胞。这导致了白血病,淋巴瘤和多发性骨髓瘤的成功结果,为扩大汽车治疗铺平了道路。尽管取得了巨大进展,但CAR-T细胞疗法仍面临许多挑战。改进区域包括有限的T细胞持久性,肿瘤逃生,肿瘤微环境中的免疫抑制成分,癌症复发率,制造时间和生产成本。在本手稿中,我们总结了汽车技术设计和交付的创新,它们在血液恶性肿瘤中的应用,对其广泛应用的局限性,最新发展以及未来的研究范围来应对挑战,并提高其效率和持久性。
髓系恶性肿瘤中的 RAS 突变:以新见解和治疗视角重新审视旧问题
NRAS 和 KRAS 激活点突变存在于 10 – 30% 的髓系恶性肿瘤中,并且通常与增殖表型相关。RAS 突变具有等位基因特异性结构和生化特性,具体取决于热点突变,从而导致不同的生物学后果。鉴于它们在大多数髓系恶性肿瘤中的亚克隆性质,它们的克隆结构以及与其他驱动基因改变的协同模式可能会对髓系恶性肿瘤的预后和治疗产生直接的因果影响。总体而言,RAS 突变往往与慢性和急性髓系恶性肿瘤的不良临床结果有关。最近的几种预后评分系统已纳入 RAS 突变状态。虽然 RAS 突变并不总是作为独立的预后因素,但它们会显著影响疾病进展和生存。然而,它们的临床意义取决于突变类型、疾病背景和所采用的治疗方法。最近的证据还表明,RAS 突变会导致对靶向治疗产生耐药性,尤其是 FLT3、IDH1/2 或 JAK2 抑制剂以及维奈克拉-阿扎胞苷组合。研究针对 RAS 通路内多个轴(包括上游和下游成分)的新型治疗策略和组合是一个活跃的研究领域。直接 RAS 抑制剂在实体瘤患者中的成功应用,让人们重新燃起希望,相信这一进展将转化为血液系统恶性肿瘤患者的治疗。在这篇综述中,我们重点介绍了过去十年间骨髓恶性肿瘤中 RAS 突变的关键见解,包括其流行率和分布、协同遗传事件、克隆结构和动态、预后意义和治疗靶向性。
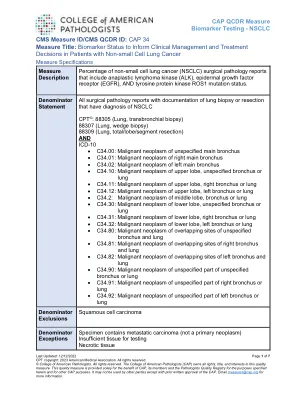
CAP QCDR 测量生物标志物检测 - NSCLC
分母声明 所有具有肺活检或切除术记录且诊断为 NSCLC CPT © 的外科病理报告:88305(肺,经支气管活检)88307(肺,楔形活检)88309(肺,全/叶/段切除术)和 ICD-10 C34.00:未指明的主支气管恶性肿瘤 C34.01:右主支气管恶性肿瘤 C34.02:左主支气管恶性肿瘤 C34.10:上叶、未指明的支气管或肺恶性肿瘤 C34.11:上叶、右支气管或肺恶性肿瘤 C34.12:上叶、左支气管或肺恶性肿瘤 C34.2:中叶、支气管或肺恶性肿瘤 C34.30:下叶、未特指的支气管或肺恶性肿瘤 C34.31:下叶、右支气管或肺恶性肿瘤 C34.32:下叶、左支气管或肺恶性肿瘤 C34.80:未特指的支气管和肺重叠部位恶性肿瘤 C34.81:右支气管和肺重叠部位恶性肿瘤 C34.82:左支气管和
信迪利单抗联合疗法治疗48例晚期恶性肿瘤患者的安全性和有效性
免疫检查点分子主要包括程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)和细胞毒性T淋巴细胞相关抗原4(CTLA-4)(3,4)。PD-1是重要的免疫抑制分子,属于CD28超家族成员(5)。PD-1/PD-L1抑制剂可以阻断PD-1与PD-L1的结合,阻断负向调控信号,恢复T细胞活性,增强抗肿瘤免疫应答,从而达到抗肿瘤的作用(6,7)。PD-1和PD-L1抑制剂在多种晚期恶性肿瘤的治疗中均显示出显著的疗效。以PD-1单抗和PD-L1单抗(8-10)为代表的药物在非小细胞肺癌、食管癌、微卫星不稳定肿瘤的治疗上取得突破,被批准用于治疗多种恶性肿瘤。近年来,免疫检查点抑制剂(ICI)让免疫治疗在肿瘤治疗中备受关注。国产廉价PD-1单抗的逐步上市,将使更多的中国晚期癌症患者受益。信迪利单抗是国产PD-1抗体,有研究表明,在外周血单个核细胞(PBMC)和注射PBMC的小鼠中,信迪利单抗的PD-1占有率高于nivolumab和pembrolizumab。在患者中,单次静脉输注辛蒂利单抗后,观察到4周内PD-1的持续占有率≥95%(11)。在多项研究中,该药物对多种类型的癌症均显示出良好的抗肿瘤作用。