XiaoMi-AI文件搜索系统
World File Search System如果我没有爱,我就什么都不是!
预言是不完整的。当那完成的时候,部分的将被消除。当我还是个孩子的时候,我说话像个孩子,思考像个孩子,推理也像个孩子。如今我已经是一个男人,我已摆脱了孩童般的束缚。我们
每日爱荷华人 (爱荷华州爱荷华城),1990-08-21
VI 可能会分阶段完成街道建设。由于紧急车辆通道项目的预计成本为 300 万美元,但 Gibson 表示,北国会街已成为校园内最重要的服务车辆通道。他补充说,拟议道路沿线的建筑物数量有限,无法改变校园通道的性质,一些服务车辆无法进入,他说。Gibson 说。他补充说,当服务车辆驶过时,行人必须移到道路两侧的安全区。
人类对致癌病毒的先天免疫缺陷
致癌病毒是可导致肿瘤的病毒。目前有七种病毒被确认为人类致癌病毒:爱泼斯坦-巴尔病毒 (EBV)、卡波西肉瘤相关疱疹病毒 (KSHV,也称为 HHV8)、人乳头瘤病毒 (HPV)、乙型肝炎病毒 (HBV)、丙型肝炎病毒 (HCV)、人类 T 淋巴细胞病毒-1 (HTLV-1) 和默克尔细胞多瘤病毒 (MCPyV)。感染这些致癌病毒导致的临床表型范围从无症状感染到侵袭性癌症。患有先天性免疫缺陷 (IEI) 的患者容易患上由窄谱或广谱病原体引起的传染病,在某些情况下包括致癌病毒。对 IEI 患者的研究加深了我们对控制 EBV、HHV8 和 HPV 感染的非冗余机制的理解。导致易患致癌 HBV、HCV、HTLV-1 和 MCPyV 表现的人类遗传因素仍不清楚。我们在此简要回顾目前已知的 IEI 导致易患严重感染致癌病毒的情况。
探索自身免疫性疾病的病毒触发因素
病毒式暴露是自身免疫性疾病的驱动力朱迪思·A·詹姆斯(Judith A.SLE对女性的影响不成比例,每个男人都患有9名妇女。这种情况特别对15-45岁的美国女性和有色妇女提出了重大的健康问题,强调了迫切需要重点研究来解决这些差异。在传染剂,尤其是病毒中,爱泼斯坦 - 巴尔病毒(EBV)与SLE密切相关。这种大型,包裹的双链DNA疱疹病毒主要靶向上皮细胞和B细胞。eBV具有双相生命周期,始于裂解阶段,该病毒在感染细胞中积极复制,从而导致新病毒颗粒的产生和释放。在裂解阶段之后,EBV转变为潜在阶段,在此期间,该病毒在记忆B细胞中处于偶发状态。在这种休眠状态下,EBV可以在宿主中持续存在,而不会进行连续的主动复制。
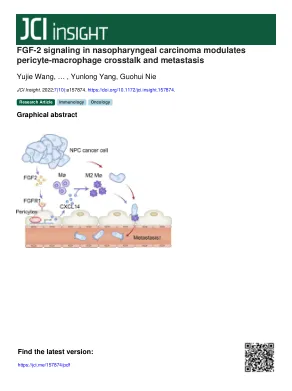
鼻咽癌中的FGF-2信号传导调节周围巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年占73,000人死亡,东南亚的发病率最高(1,2)。通常在NPC发育中促成因素,包括爱泼斯坦 - 巴尔病毒(EBV)感染,遗传易感性和生活方式(2)。在临床上,放疗和化学疗法是针对早期NPC和非转移性NPC患者进行的(3)。但是,转移性NPC患者的治疗选择有限。转移性NPC似乎是一组具有广泛存活的肿瘤,肺,肝脏和骨骼是远处转移的最常见部位(4)。靶向治疗被认为是进一步延长NPC患者存活的有效方法。尽管如此,几项临床试验表明,与传统的化学治疗疗法相比,靶向Bevacizumab的血管内皮生长因子(VEGF)SIG-NALINing或靶向cetuximab的靶向表皮生长因子(EGF)信号传导,并未显示NPC患者的临床益处(5-7)。因此,迫切需要对NPC的Novel分子靶向疗法。NPC转移的机械研究是开发新的靶向疗法的基础。目前,NPC转移研究主要是
通过瓦斯坦斯坦空间中的近端梯度下降
基于流量的生成模型在计算数据生成和可能性方面具有某些优势,并且最近显示出具有竞争性的经验性能。与基于基于分数的扩散模型的累积理论研究,基于流的模型的分析,这些模型在正向(数据到噪声)和反向(噪声到数据)方向上都是确定性的,这仍然很少。在本文中,我们提供了一种理论保证,即通过渐进流模型,即所谓的JKO流程模型生成数据分布,该模型在正常化的流网络中实现了Jordan-Kinderleherer-Otto(JKO)方案。利用在瓦斯斯坦空间中近端梯度下降(GD)的指数收敛性,我们证明了kullback-leibler(KL)通过JKO流量模型(ε2)为O(ε2)保证数据生成数据时,当使用n log(1 /ε)许多jko步骤(1 /ε)许多JKO步骤(n残基块)中,prowter strorder in Flow pronder in prift stry stred step step step erry是ε在ε是ε在ε中均为ε。对数据密度的假设仅仅是有限的第二时刻,该理论扩展到无密度的数据分布以及在反向过程中存在反转误差的情况下,我们获得了KL-W 2混合错误保证。证明,JKO型W 2-proximal GD的非反应收敛速率已被证明是一类凸目标函数的一类凸出物质功能,该函数包括KL差异作为一种特殊情况,可以具有独立的利益。分析框架可以扩展到应用于基于流的生成模型的其他一阶瓦斯汀优化方案。
研讨会报告:癌症暴露的分子特征
缩写和首字母缩略词列表 AA 马兜铃酸 APOBEC 载脂蛋白 B mRNA 编辑催化多肽样 BCERP 乳腺癌和环境研究计划 BMI 体重指数 CIMP CpG 岛甲基化表型 COSMIC 癌症体细胞突变目录 EBV 爱泼斯坦-巴尔病毒 EWAS 表观基因组关联研究 GC-HRMS 气相色谱-高分辨率质谱法 HCC 肝细胞癌 HPLC-ICPMS 高效液相色谱-电感耦合等离子体质谱法 HTAN 人类肿瘤图谱网络 ICR 印记控制区 ICPMS 电感耦合等离子体质谱法 iPSC 诱导多能干细胞 MC-ICPMS 多接收电感耦合等离子体质谱法 MEC 多民族队列 MEF 小鼠胚胎成纤维细胞 NCI 国家癌症研究所 NIEHS 国家环境健康科学研究所 NIH 国立卫生研究院 PFAS 全氟和多氟烷基物质 RCC 肾细胞癌 SBS 单碱基置换 TCGA 癌症基因组图谱
鼻咽癌中的 FGF-2 信号调节周细胞-巨噬细胞串扰和转移
引言鼻咽癌(NPC)在2018年造成73,000人死亡,东南亚的发病率最高(1,2)。鼻咽癌发展的常见因素包括爱泼斯坦-巴尔病毒(EBV)感染、遗传易感性和生活方式(2)。临床上,放疗和化疗是推荐用于早期鼻咽癌和非转移性鼻咽癌患者(3)。然而,转移性鼻咽癌患者的治疗选择有限。转移性鼻咽癌似乎是一类异质性肿瘤,生存范围广泛,肺、肝和骨是远处转移最常见的部位(4)。靶向治疗被公认为进一步延长鼻咽癌患者生存的有效方法。然而,多项临床试验表明,与常规放化疗相比,针对血管内皮生长因子 (VEGF) 信号的贝伐单抗或针对表皮生长因子 (EGF) 信号的西妥昔单抗在鼻咽癌患者中未显示出临床益处 (5–7)。因此,迫切需要开发针对鼻咽癌的新型分子靶向治疗。鼻咽癌转移机制研究是开发新型靶向治疗的基础。目前,鼻咽癌转移研究主要集中在