XiaoMi-AI文件搜索系统
World File Search System易感阿尔茨海默氏病的糖尿病小鼠的认知下降大于野生型
在这项工作中,我们检验了以下假设:2型糖尿病患者(T2DM)的痴呆症的发展需要对神经退行性疾病的易感性的遗传背景。作为概念证明,我们诱导了中年Happ NL/F小鼠的T2DM,这是阿尔茨海默氏病的临床前模型。我们表明,与野生型小鼠相比,T2DM在这些小鼠中产生更严重的行为,电生理和结构改变。从机械上讲,defits不与ββ或神经蛋白浮肿的毒性形式较高,而是通过γ-分泌酶活性,较低的突触蛋白的降低以及增加TAU的磷酸化的降低而平行。对HAPP NL/F和野生型小鼠大脑皮层的RNA-Seq分析表明,由于跨膜运输的缺陷,前者可能更容易受到T2DM的影响。这项工作的结果一方面证实了遗传背景在T2DM个体认知障碍严重程度中的重要性,另一方面,在涉及的机制中暗示了抑制γ-分泌酶活性。
易感阿尔茨海默氏病的糖尿病小鼠的认知下降大于野生型
在这项工作中,我们检验了以下假设:2型糖尿病患者(T2DM)的痴呆症的发展需要对神经退行性疾病的易感性的遗传背景。作为概念证明,我们诱导了中年Happ NL/F小鼠的T2DM,这是阿尔茨海默氏病的临床前模型。我们表明,与野生型小鼠相比,T2DM在这些小鼠中产生更严重的行为,电生理和结构改变。从机械上讲,defits不与ββ或神经蛋白浮肿的毒性形式较高,而是通过γ-分泌酶活性,较低的突触蛋白的降低以及增加TAU的磷酸化的降低而平行。对HAPP NL/F和野生型小鼠大脑皮层的RNA-Seq分析表明,由于跨膜运输的缺陷,前者可能更容易受到T2DM的影响。这项工作的结果一方面证实了遗传背景在T2DM个体认知障碍严重程度中的重要性,另一方面,在涉及的机制中暗示了抑制γ-分泌酶活性。
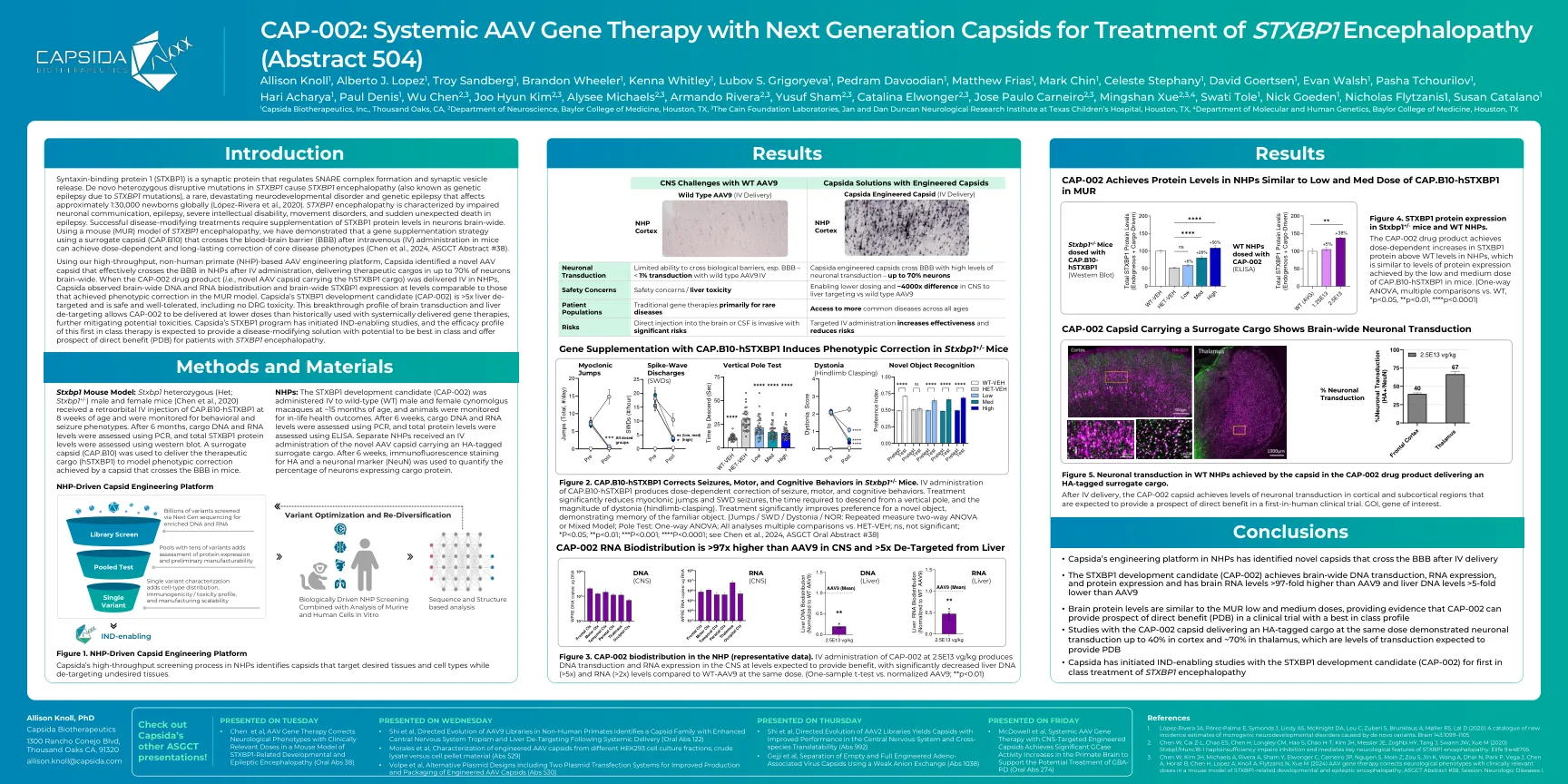
CAP-002:与下一代Capsids治疗STXBP1脑病的全身性AAV基因治疗(摘要504)
语法结合蛋白1(STXBP1)是一种突触蛋白,可调节SNARE复合物的形成和突触囊泡释放。STXBP1中的从头杂合性突变引起的STXBP1脑病(也称为STXBP1突变引起的遗传性癫痫),一种罕见的,破坏性的神经发育障碍和遗传性癫痫,影响全球范围1:30,000 Newborns Globally lul low low peepepepepepepepepez-ara eala and and newborns。STXBP1脑病的特征在于神经元交流,癫痫,严重的智力障碍,运动障碍和癫痫中突然意外死亡的特征。成功修改疾病的治疗需要在整个神经元中补充STXBP1蛋白水平。使用STXBP1脑病的小鼠(MUR)模型,我们证明,使用替代capsid(Cap.b10)的基因补充策略,该策略在小鼠中施用后跨液脑屏障(BBB)跨越血脑屏障(BBB),可以实现剂量依赖于剂量依赖于剂量的和长期的核心疾病(Ch)。 #38)。
NaCC1突变模型的稀有神经发育障碍具有潜在的突触功能障碍
在C.892C> T(P.ARG298TRP)上,转录阻遏核与伏隔核核的错义突变在染色体19上导致严重的神经发育延迟(Schoch等,2017)。为了建模这种疾病,我们用同源突变(NACC1 +/R284W)设计了第一个小鼠模型,并检查了E17.5到8个月的小鼠。两个性别的体重增加,癫痫样排放量延迟,并改变了皮质脑电图,行为癫痫发作和明显的后肢紧握的功率谱分布;女性在一个开放式场上显示thigmotaxis。在皮质中,NACC1长同工型(含有突变)从3个月增加到6个月,而短的同工型(在人类中不存在,在小鼠中缺乏AAR284),从产后日开始稳步上升(p)7。核NaCC1免疫反应性在皮质锥体神经元和含有中间神经元的Parval-bumin的核NACC1免疫反应性升高,而在星形胶质细胞或寡头胶质细胞核中不增加。星形胶质细胞过程中的神经胶质纯酸性蛋白质染色减少。P14突变小鼠皮层的 RNA-SEQ揭示了1,000多种差异表达的基因(DEGS)。 神经胶质文字被下调并上调突触基因。 来自上调DEG的顶级基因本体术语与结合后和离子通道功能有关,而下调的DEG富含与代谢功能,线粒体和核糖的术语相关的术语。 突触蛋白的水平已更改,但突触接触的数量和长度在3个月时没有改变。 纯合性恶化了一些表型,包括产后存活,体重增加延迟和核NACC1的增加。RNA-SEQ揭示了1,000多种差异表达的基因(DEGS)。神经胶质文字被下调并上调突触基因。来自上调DEG的顶级基因本体术语与结合后和离子通道功能有关,而下调的DEG富含与代谢功能,线粒体和核糖的术语相关的术语。突触蛋白的水平已更改,但突触接触的数量和长度在3个月时没有改变。纯合性恶化了一些表型,包括产后存活,体重增加延迟和核NACC1的增加。该小鼠模型模拟了一种罕见的自闭症形式,对于评估病理生理学和治疗干预靶标的是必不可少的。
一种针对神经元精确基因组编辑的优化CRISPR/CAS9方法
摘要在非分裂细胞(如神经元)中,大型DNA片段对标记内源性蛋白的有效敲入仍然尤其具有挑战性。,我们以T WO(TKIT)指南为基于CRISPR/CAS9的新方法开发了T ARGE,以高效且精确的基因组敲入。通过靶向非编码区域TKIT对indel突变具有抗性。我们证明了具有各种标签的内源性突触蛋白的TKIT标记,在小鼠原发性培养的神经元中的效率高达42%。在小鼠中利用子宫电穿孔或病毒注射,可以将AMPAR亚基标记为超超金霉素,从而可以使用两光子显微镜在体内可视化内源性AMPARS。我们进一步使用TKIT来评估内源性AMPAR的迁移率,并在光漂白后荧光回收率。最后,我们表明TKIT可用于标记大鼠神经元中的AMPAR,在另一种模型生物体中证明了精确的基因组编辑,并突出了TKIT作为可视化内源性蛋白质的方法的广泛潜力。
生理温度下制备的急性脑切片在突触功能表征中的优势
急性脑切片制备是研究大脑突触功能特征的有力实验模型。尽管通常在冰冷温度 (CT) 下切割脑组织以方便切片并避免神经元损伤,但暴露于 CT 会导致突触的分子和结构变化。为了解决这些问题,我们研究了在冰冷和生理温度 (PT) 下制备的小鼠急性小脑切片中突触的超微结构和电生理特征。在 CT 下制备的切片中,我们发现脊柱明显丢失和重建、突触小泡重排和突触蛋白减少,而所有这些在 PT 下制备的切片中均未检测到。与这些结构发现一致,在 PT 下制备的切片显示出更高的释放概率。此外,在 PT 下制备允许在切片后立即进行电生理记录,从而与 CT 下相比,运动学习后长期抑郁 (LTD) 的可检测性更高。这些结果表明,在 PT 下切片制备对于研究不同生理条件下的突触功能具有显着优势。
大脑IGF-I调节LTP,空间记忆和性二态行为
胰岛素样生长因子-I(IGF-I)发挥了多种作用,但是从不同来源的IGF-I的作用却鲜为人知。在这里,我们探讨了IGF-I条件缺失在神经系统(IGF-IΔ /δ)中的功能和行为后果,并证明长期增强在海马切片中受到了损害。此外,IGF-iΔ /δ小鼠在莫里斯水迷宫中显示出空间记忆,并且在开放式和rota-Rod-Rod测试中,IGF-I CTRL / CTRL小鼠在IGF-IΔ /δ小鼠中所显示的显着性依赖性差异消失了。脑IGF-1缺失使齿状陀螺(DG)的颗粒细胞层混乱,并修改了GAD和VGLUT1的相对表达,它们优先定位于抑制性和兴奋性的前偶突触前末端。此外,IGF-I缺失改变了参与受体传统,突触蛋白和蛋白质与雌激素和雄激素代谢的蛋白质。我们的发现表明大脑IGF-I对于长期增强至关重要,并且可能通过维持颗粒状细胞层结构和突触相关蛋白质模块的稳定性来参与空间记忆和性二态行为的调节。
NEXMIF/KIDLIA 基因敲除小鼠展现出自闭症......
自闭症谱系障碍 (ASD) 是一种异质性神经发育障碍,表现为社交互动障碍、沟通障碍以及限制性和重复性行为。ASD 具有很强的遗传基础,迄今为止已发现了许多与 ASD 相关的基因。我们之前的研究表明,X 连锁基因 NEXMIF/KIDLIA 表达的缺失与具有自闭症特征和智力障碍 (ID) 的患者有关。为了进一步确定基因在疾病中的因果作用,并了解病理学背后的细胞和分子机制,我们生成了 NEXMIF 敲除 (KO) 小鼠。我们发现雄性 NEXMIF KO 小鼠表现出社交能力和沟通能力下降、重复梳理行为增多以及学习和记忆能力下降。NEXMIF/KIDLIA 表达的缺失导致突触密度和突触蛋白表达显著降低。通过测量海马中的兴奋性微征和突触后电流,雄性 KO 动物始终表现出异常的突触功能。这些发现表明,NEXMIFKO 小鼠重现了人类疾病的表型。NEXMIFKO 小鼠模型将成为研究 ASD 所涉及的复杂机制和开发这种疾病的新型疗法的宝贵工具。
循环肿瘤 DNA 图谱识别转化为...
肿瘤发展为去势抵抗性神经内分泌前列腺癌 (CRPC-NE) 表型的组织学转化为 AR 独立治疗抵抗的机制 (3-5)。转移性活检显示小细胞癌的形态学特征,通常 AR 表达低或缺失,下游 AR 调节标志物(如前列腺特异性抗原 (PSA))下调,以及经典神经内分泌标志物(如嗜铬粒蛋白、突触蛋白)表达 (6, 7)。CRPC-NE 预后不良,部分原因是诊断晚和缺乏有效治疗方法 (5, 8)。与其他低分化神经内分泌癌 (9, 10) 类似,CRPC-NE 通常伴有 RB1 和 TP53 的基因组缺失 (4, 6, 11, 12)。然而,RB1 和 TP53 功能丧失变异并非 CRPC-NE 所特有,在去势抵抗性腺癌的一个子集中也观察到了这种变异 (4)。先前的临床和临床前研究支持了一种转分化过程,即 CRPC-NE 从腔内前列腺腺癌前体克隆进化而来 (11, 13–16)。早期前列腺癌基因组变异得以保留,但其他基因组和表观遗传变异则是后天获得的 (11, 14, 17)。这种谱系可塑性在患者身上如何以及何时表现出来尚不清楚,早期检测 CRPC-NE 是否可以改善预后也尚不清楚。
利用连续 CRISPR/Cas9 基因编辑技术对神经元蛋白进行双链标记和操作
CRISPR/Cas9 介导的基因敲入方法能够标记单个内源性蛋白质,从而如实地确定它们在细胞中的时空分布。然而,由于编辑事件之间存在串扰,因此在神经元中可靠地多路复用基因敲入事件仍然具有挑战性。为了克服这个问题,我们开发了条件性激活基因敲入表达 (CAKE),从而实现高效、灵活和准确的多路复用基因组编辑。为了减少串扰,CAKE 基于顺序重组酶驱动的向导 RNA (gRNA) 表达来控制每个供体序列的基因组整合时间。我们表明,CAKE 广泛应用于大鼠神经元,以共标记各种内源性蛋白质,包括细胞骨架蛋白、突触支架、离子通道和神经递质受体亚基。为了充分利用 CAKE,我们使用超分辨率显微镜解决了内源性突触蛋白的纳米级共分布,表明它们的共组织与突触大小相关。最后,我们引入了可诱导二聚化模块,可精确控制活神经元中的突触受体动力学。这些实验凸显了 CAKE 揭示新生物学见解的潜力。总而言之,CAKE 是一种多功能的多重蛋白质标记方法,可以检测、定位和操纵神经元中的内源性蛋白质。