XiaoMi-AI文件搜索系统
World File Search System马穆鲁克、财产权和经济发展
摘要 有保障的产权被认为是快速增长的经济体的共同制度特征。尽管随着时间的推移,世界各地盛行着不同的产权制度,但对西欧以外社会的历史产权进行实证研究的学术研究相对较少。本文使用来自埃及马穆鲁克苏丹国(公元 1250-1517 年)的数据,详细描述了土地保有权模式,并确定了与埃及奴隶士兵马穆鲁克和苏丹之间的制度交易相关的不动产持有量的变化。尽管农业用地是国家的集体资源,但个别马穆鲁克(即国家行为者)建立了宗教捐赠基金,作为不允许将马穆鲁克身份转让给儿子的私有化解决办法。本文对中世纪埃及土地持有模式的描述提供了一个实证说明,说明了中东制度与世界其他地区的制度有何不同,以及政权如何以及为何因其产权制度而承受政治压力。
马修·索尔·莱弗博士
2021 年 6 月 = 2021 年 8 月:Pablo Labbate,查普曼软件工程专业,IQS 暑期研究奖学金。项目:使用 IBM 量子计算机对量子状态现实进行实验界限 2020 年 9 月 – 2021 年 8 月:Jacob Anabi,查普曼物理学专业,PHYS 491 师生研究/创作活动和 Schmid 暑期研究奖学金。项目:量子通道的兼容性、IBM 量子计算机的理论独立基准测试 2019 年 9 月 – 2019 年 5 月:Tucker Arrants,查普曼物理学专业,PHYS 491 师生研究/创作活动。项目:量子条件状态的应用 2019 年 1 月 – 2019 年 12 月 Conner Carnahan,查普曼物理学专业,PHYS 491项目:量子达尔文主义中可观测量的兼容性 2018 年 6 月 - 2018 年 8 月:查普曼大学物理学专业的 Aaron Grisez 与我一起访问了圆周研究所,并在 2018 年秋季获得了查普曼大学的 2 个研究学分。项目:逆向可区分理论
附件一 产品特性概述
此药品需要接受额外监控。这将使我们能够快速识别新的安全信息。要求医疗保健专业人员报告任何疑似不良反应。有关如何报告不良反应,请参阅第 4.8 节。 1. 药品名称 预充式注射笔 Wegovy 0.25 mg 注射液 预充式注射笔 Wegovy 0.5 mg 注射液 预充式注射笔 Wegovy 1 mg 注射液 预充式注射笔 Wegovy 1.7 mg 注射液 预充式注射笔 Wegovy 2.4 mg 注射液 预充式注射笔 Wegovy 0.25 mg FlexTouch 注射液 预充式注射笔 Wegovy 0.5 mg FlexTouch 注射液 预充式注射笔 Wegovy 1 mg FlexTouch 注射液 预充式注射笔 Wegovy 1.7 mg FlexTouch 注射液 预充式注射笔 Wegovy 2.4 mg FlexTouch 注射液 2. 定性和定量组成 预充式笔,单剂量 Wegovy 0.25 mg 注射液 每支单剂量预充式注射笔含 0.25 mg 索马鲁肽*,溶于 0.5 mL 溶液。一 mL 溶液含有 0.5 mg 索马鲁肽*。Wegovy 0.5 mg 注射液 每支单剂量预充式注射笔含 0.5 mg 索马鲁肽*,溶于 0.5 mL 溶液。一 mL 溶液含有 1 mg 索马鲁肽*。Wegovy 1 mg 注射液 每支单剂量预充式注射笔含 1 mg 索马鲁肽*,溶于 0.5 mL 溶液。一 mL 溶液含有 2 mg 索马鲁肽*。Wegovy 1.7 mg 注射液 每支单剂量预充式注射笔含 1.7 mg 索马鲁肽*,溶于 0.75 mL 溶液。一 mL 溶液含有 2.27 mg 索马鲁肽*。 Wegovy 2.4 mg 注射液 每支单剂量预充笔含 2.4 mg 索马鲁肽*,溶于 0.75 mL 溶液中。一 mL 溶液含有 3.2 mg 索马鲁肽*。预充笔,FlexTouch Wegovy 0.25 mg FlexTouch 预充笔注射液 每支预充笔含 1 mg 索马鲁肽*,溶于 1.5 mL 溶液中。一 mL 溶液含有 0.68 mg 索马鲁肽*。一支预充笔含 4 剂 0.25 mg。Wegovy 0.5 mg FlexTouch 预充笔注射液 1.5 mL: 每支预充笔含 2 mg 索马鲁肽*,溶于 1.5 mL 溶液中。一 mL 溶液含有 1.34 mg 索马鲁肽*。一支预充笔含 4 剂 0.5 mg。 3 毫升:每支预充式注射笔含有 2 毫克索马鲁肽*,溶于 3 毫升溶液中。1 毫升溶液含有 0.68 毫克索马鲁肽*。一支预充式注射笔含有 4 剂 0.5 毫克。
案卷编号:FDA-2017-N-2562
诺和诺德公司 (“诺和诺德”) 以此提交文件,将索马鲁肽产品列入《联邦食品、药品和化妆品法案》(“FDCA”) 第 503A(b)(3) 和 503B(a)(6) 条规定的存在明显配制困难的药品清单 (“明显配制困难清单”或“DDC 清单”)。索马鲁肽产品属于这些清单,因为其配方、给药机制、剂型、生物利用度实现、配制过程以及物理化学和分析测试都很复杂。我们请求 FDA 召集并咨询配制咨询委员会,讨论将索马鲁肽产品添加到两个 DDC 清单中,并颁布将索马鲁肽产品添加到 DDC 清单的法规。为了保护第 503A 条规定的索马鲁肽产品配制对公众健康造成的危害,我们进一步请求 FDA 发布直接最终规则,将索马鲁肽产品添加到 FDCA 第 503A 条规定的 DDC 清单中。最后,我们请求药房配制咨询委员会和药物安全和风险管理咨询委员会联合审查此提名;纳入在内分泌学、糖尿病、肥胖症、心脏病和免疫原性方面具有专业知识的委员会成员;并让 FDA 的免疫原性审查委员会参与。
糖尿病、GLP-1 初级保健启动指南
表 1. 患者因素 建议的 GLP-1 激动剂 依从性 每日 - 利拉鲁肽 每周 - 索马鲁肽/度拉鲁肽 手动灵活性/易用性 度拉鲁肽 - 已安装针头的一次性使用笔 针头恐惧症 度拉鲁肽 - 针头是隐藏的,有针头恐惧症的人可能会发现这种准备是可以接受的 如果不能接受皮下给药,可以考虑索马鲁肽 (口服)。 需要第三方给药 度拉鲁肽 - 针头受伤的风险很小 参与 度拉鲁肽的剂量滴定是可选的。 可以从 1.5 毫克开始,并保持该剂量。 其他需要剂量滴定。 视网膜病变 增生性视网膜病变患者不应使用索马鲁肽 (口服或皮下)。心血管益处 首选具有已证实的心血管益处的 GLP-1 激动剂(目前为度拉鲁肽 1 、利拉鲁肽 2 或皮下注射索马鲁肽) 3 。 1 度拉鲁肽和 2 型糖尿病患者的心血管结局(REWIND):一项双盲、随机安慰剂对照试验 - 柳叶刀 2. 利拉鲁肽和 2 型糖尿病患者的心血管结局 | NEJM 3. 索马鲁肽和 2 型糖尿病患者的心血管结局 | NEJM
iXB 401 大鼠研究结果
新加坡,2024 年 11 月 19 日 — iX Biopharma Ltd.(“公司”)是一家专门从事药物输送系统的专业制药公司,也是创新健康保健食品的领导者,该公司今天宣布了一项单剂量药代动力学研究的积极结果,表明新型索马鲁肽舌下片 iXB 401 在 12 只 Sprague-Dawley 大鼠中进行的临床前研究中,其生物利用度显著提高——大约高 20 倍——高于口服索马鲁肽片剂 Rybelsus ®。索马鲁肽是一种 GLP-1 受体激动剂,可有效治疗糖尿病和肥胖症。iXB 401 片采用 iX Biopharma 的专利片舌下药物输送技术,并含有专有的渗透促进剂和粘膜粘附成分配方,旨在增强索马鲁肽的舌下吸收和全身生物利用度。通过绕过胃肠道,iXB 401 可能成为现有口服索马鲁肽片剂 Rybelsus ® 的更稳定、更有效的替代品。结果表明,与 Rybelsus ® 相比,iXB 401 在 8 小时内的血浆浓度-时间曲线下面积 (AUC) 显著增加。iXB 401 的 AUC 0-8h 为 11,000 ng*h/mL,大大超过 Rybelsus ® 的 553 ng*h/mL AUC (p< 0.005)。此外,与 Rybelsus ® (平均 CV 为 141%) 相比,iXB 401 的血浆浓度变化性更低 (平均 CV 为 87%),凸显出其作为非侵入性舌下给药方案的潜力,且剂量和副作用可能更低。 iX Biopharma 首席运营官兼首席医疗官 Janakan Krishnarajah 博士表示:“这项研究代表了索马鲁肽舌下给药潜力的重大突破,提供了一种可以重塑索马鲁肽和其他 GLP-1 类似物和肽给药方式的替代方案。”“通过舌下片剂递送索马鲁肽,我们满足了患者的关键需求:避免注射,从而提高偏好和依从性,并可能提供更好的副作用。除了患者利益之外,这项技术还可以减轻制造和供应限制,支持下一代治疗的可扩展性。”这些发现对于 iXB 401 的持续开发非常鼓舞人心,表明以这种创新、非侵入性和方便的剂型使用较低剂量的索马鲁肽有可能获得疗效结果。这种方法可以为提高索马鲁肽治疗的可及性和可持续性提供新的可能性。该药代动力学研究由 Eurofins Advinus Biopharma Services 进行,遵循动物实验控制和监督委员会 (CCSEA) 和机构动物伦理委员会 (IAEC) 批准的方案。
泊马格鲁美特和 TS 的 RCT
谷氨酸神经传递是抗精神病药物开发的优先目标。在两项 Ib 期机制验证研究中评估了两种代谢型谷氨酸受体 2/3 (mGluR2/3) 激动剂(pomaglumetad [POMA] 和 TS-134),这些研究的设计相似,并使用相同的临床评估和 pharmacoBOLD 方法。在一项随机对照试验中,在双盲条件下对 POMA 进行了为期 10 天的检查,剂量为 80 或 320 mg/d POMA 与安慰剂(1:1:1 比例)。TS-134 试验是一项随机、单盲、为期 6 天的研究,研究剂量为 20 或 60 mg/d TS-134 与安慰剂(5:5:2 比例)。主要结果是氯胺酮引起的背侧前扣带皮层 (dACC) 药物 BOLD 变化和简明精神病评定量表 (BPRS) 上反映的症状。两项试验同时进行。95 名健康志愿者随机分配到 POMA 组,63 名分配到 TS-134 组。高剂量 POMA 显着减少了组内和组间氯胺酮引起的 BPRS 总体症状(分别为 p < 0.01,d = − 0.41;p = 0.04,d = − 0.44),但两种 POMA 剂量均未显着抑制氯胺酮引起的 dACC 药物 BOLD。相反,低剂量的 TS-134 导致 BPRS 阳性症状(分别为 p = 0.02,d = − 0.36;p = 0.008,d = − 0.82)和 dACC pharmacoBOLD(分别为 p = 0.004,d = − 0.56;p = 0.079,d = − 0.50)在组内和组间均有中度至大幅度的减少,这是使用汇总的跨研究安慰剂数据得出的。高剂量的 POMA 对临床症状有显著影响,但对靶标参与没有影响,这表明可能仍需要更高的剂量,而低剂量的 TS-134 显示出症状减轻和靶标参与的证据。这些结果支持进一步研究 mGluR2/3 和其他以谷氨酸为靶点的精神分裂症治疗。
索乐匹尼布(Syk) ITP治疗领域新希望
SYHX1901 JAK/Syk 抑制剂 石药集团 斑块状银屑病 ; 白癜风 / II 期 类风湿性关节炎 ; 系统性红斑狼疮 / I 期 TOP1288 p38 MAPK/Src/Syk 抑制剂 TopiVert 溃疡性结肠炎 II 期 / cevidoplenib Syk 抑制剂 Genosco 免疫性血小板减少症 ; 类风湿性关节炎 II 期 / lanraplenib Syk 抑制剂 吉利德 干燥综合征 ; 狼疮性肾炎 ; 急性髓系白血病 II 期 / mivavotinib Syk/Flt3 抑制剂 Calithera Biosciences 弥漫性大 B 细胞淋巴瘤 II 期 /
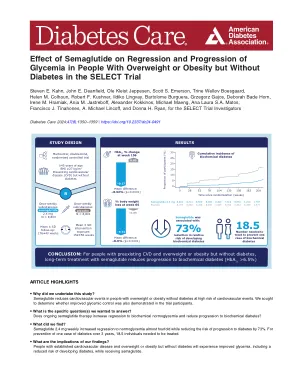
SELECT 试验中索马鲁肽对超重或肥胖但无糖尿病人群血糖回升和进展的影响
结果 在 17,604 名参与者中,8,803 名被分配到索马鲁肽组,8,801 名被分配到安慰剂组。平均±SD 干预暴露时间为 152±56 周,随访时间为 176±40 周。两个治疗组中,参与者的 HbA 1c 平均最低点均为 20 周。此后,两个组的 HbA 1c 增加幅度相似,平均差异为 2-0.32 个百分点(95% CI 2-0.33 至 2-0.30;2-3.49 mmol/mol [2-3.66 至 2-3.32]),并且在整个研究过程中,该差异有利于索马鲁肽组(P < 0.0001)。体重在 65 周时达到稳定,使用索马鲁肽后体重降低了 8.9%。在第 156 周,接受索马鲁肽治疗的患者中,血糖恢复正常的患者比例较大(69.5% vs. 35.8%;P < 0.0001),而到第 156 周时患生化糖尿病的患者比例较小(1.5% vs. 6.9%;P < 0.0001)。需要治疗的患者数量为 18.5 人,才能预防一例糖尿病。病情的逆转和进展都取决于基线血糖,体重减轻的幅度对 24.5% 的进展和 27.1% 的逆转具有重要意义。
E246449A_石药集团制药 (SYH9017) 1..2
该产品为国内首个获得临床试验批件的每月一次给药的索马鲁肽制剂。该产品利用集团的长效给药技术平台及生物相容性良好的辅料,通过皮下注射形成凝胶剂型,实现长效给药。与目前市场上每周一次给药的索马鲁肽注射液相比,该产品有望将给药时间延长至每月一次,大幅提高患者用药依从性,具有明显的临床优势。临床前研究表明,与目前市场上的索马鲁肽注射液相比,该产品具有相当的减肥效果、良好的安全性及显著延长的半衰期,支持每月一次制剂的临床开发。