XiaoMi-AI文件搜索系统
World File Search SystemAY 染色体连锁基因组编辑器,用于高效种群 1
。CC-BY-NC-ND 4.0 国际许可,根据 提供(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。它是此预印本的版权持有者此版本于 2024 年 5 月 14 日发布。;https://doi.org/10.1101/2024.05.14.594116 doi:bioRxiv 预印本
使用紧凑编辑器CasΦ对植物进行基因组编辑
(未经同行评审认证)是作者/资助者。保留所有权利。未经许可不得重复使用。此预印本的版权所有者此版本于 2022 年 11 月 1 日发布。;https://doi.org/10.1101/2022.10.31.514567 doi:bioRxiv preprint
人类细胞中 DNA 靶向 CRISPR 编辑器的比较
© 作者 2023。开放存取 本文根据知识共享署名 4.0 国际许可进行授权,允许以任何媒体或格式使用、共享、改编、分发和复制,只要您给予原作者和来源适当的信任,提供知识共享许可的链接,并指明是否做了更改。 本文中的图片或其他第三方资料包含在文章的知识共享许可中,除非资料的致谢中另有说明。 如果资料未包含在文章的知识共享许可中,且您的预期用途不被法定规定允许或超出允许用途,则需要直接从版权所有者处获得许可。 要查看此许可证的副本,请访问 http://creativecommons.org/licenses/by/4.0/ 。知识共享公共领域贡献豁免(http://creativeco mmons.org/publicdomain/zero/1.0/)适用于本文中提供的数据,除非数据来源中另有说明。
合理设计 APOBEC3B 胞嘧啶碱基编辑器,提高特异性
金帅, 1, 2, 6 费红远, 1, 2, 6 朱子旭, 1, 2, 6 罗英锋, 3, 6 刘金星, 1 高胜汉, 3 张锋, 4 陈宇航, 5 王彦鹏, 1, 2,* 和高彩霞 1, 2, 7,* 1 中国科学院遗传与发育生物学研究所、种子设计创新研究院、植物细胞与染色体工程国家重点实验室、基因组编辑中心,北京,中国 2 中国科学院大学现代农业学院,北京,中国 3 中国科学院微生物研究所、微生物资源国家重点实验室,北京,中国 4 明尼苏达大学植物与微生物生物学系、植物精准基因组学中心、微生物与植物基因组学研究所,明尼苏达州明尼阿波利斯55108,美国 5 中国科学院遗传与发育生物学研究所,种子设计创新研究院,分子发育生物学国家重点实验室,北京,中国 6 这些作者贡献相同 7 主要联系人 *通讯地址:yanpengwang@genetics.ac.cn (YW),cxgao@genetics.ac.cn (CG) https://doi.org/10.1016/j.molcel.2020.07.005
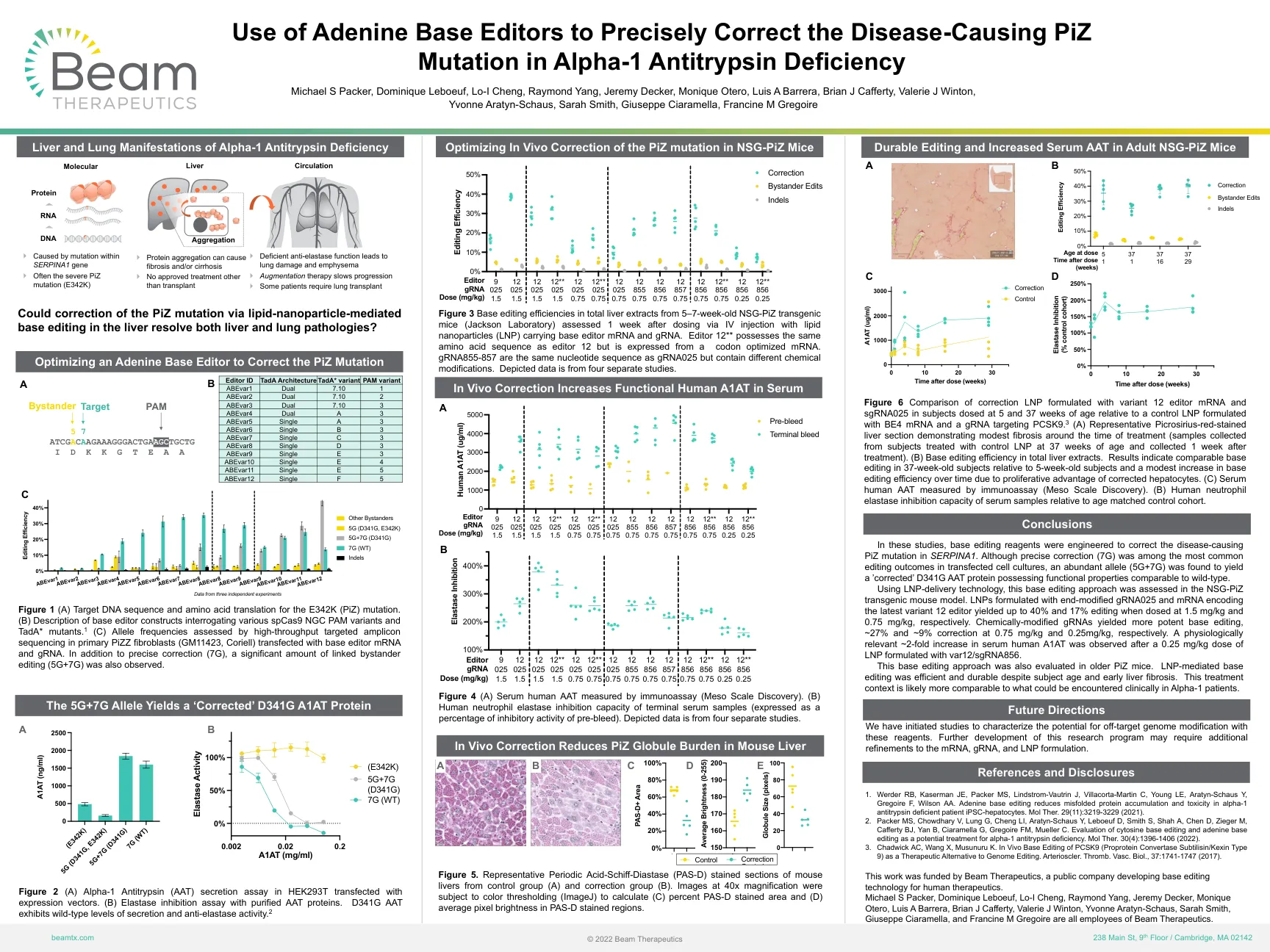
使用腺嘌呤碱基编辑器精确纠正致病的 PiZ
图 6 在 5 周龄和 37 周龄给药的受试者中,与用 BE4 mRNA 和靶向 PCSK9 的 gRNA 配制的对照 LNP 相比,用变体 12 编辑器 mRNA 和 sgRNA025 配制的校正 LNP 进行了比较。3 (A) 代表性苦味酸红染色的肝切片显示治疗期间有轻度纤维化(样本采自用对照 LNP 治疗的 37 周龄受试者,并在治疗后 1 周收集)。(B) 总肝提取物中的碱基编辑效率。结果表明,与 5 周龄受试者相比,37 周龄受试者的碱基编辑相当,并且由于校正肝细胞的增殖优势,碱基编辑效率随着时间的推移略有提高。(C) 通过免疫测定法 (Meso Scale Discovery) 测量血清人 AAT。(B) 与年龄匹配的对照组相比,血清样本的人中性粒细胞弹性蛋白酶抑制能力。
Transformer 碱基编辑器在哺乳动物细胞和小鼠中的设计与应用
将载脂蛋白 B mRNA 编辑酶、催化性多肽样胞苷脱氨酶与催化功能受损的 Cas 蛋白(例如 nCas9 或 dCas9)融合,提供了一种新型基因编辑技术,即碱基编辑,可高效地实现靶向碱基替换。然而,在碱基编辑中观察到全基因组和全转录组脱靶突变,这引发了对治疗应用的安全性担忧。之前,我们开发了一种新的碱基编辑系统,即 transformer 碱基编辑器 (tBE),可在哺乳动物细胞和小鼠中诱导高效编辑,且不会观察到全基因组或全转录组脱靶突变。这里我们描述了设计和应用 tBE 的详细方案。本方案包括设计单向导 RNA (sgRNA) 和辅助 sgRNA 对、构建构建体、确定全基因组和转录组范围的脱靶突变、生产含有 tBE 的腺相关病毒、将腺相关病毒递送到小鼠体内以及检查体内编辑效果的步骤。使用 sgRNA-辅助 sgRNA 对,tBE 的高精度碱基编辑可以在 2-3 周内(在哺乳动物细胞中)或 6-8 周内(在小鼠中)完成。整个过程可以由研究人员使用分子生物学、生物信息学和小鼠饲养的标准技术共同完成。
基于人类细胞的腺嘌呤碱基编辑器定向进化及其效率的提高
细胞生物学国家重点实验室、上海分子男科学重点实验室、中国科学院上海生物化学与细胞生物学研究所、分子细胞科学卓越创新中心
削减还是不削减:用于精准基因组工程的下一代基因组编辑器
摘要 自从首次报道将 CRISPR/Cas9 系统用于基因组工程以来,过去十年我们有效地操纵哺乳动物基因组的能力得到了显著提高。然而,未来仍存在重大挑战,阻碍了基于 CRISPR 的基因编辑技术转化为安全有效的治疗方法。由于 PAM 限制,CRISPR 系统的目标范围通常有限,脱靶活性也对治疗应用构成严重风险。此外,第一代基因组编辑器通常通过在目标位点诱导双链断裂 (DSB) 来实现所需的基因组修饰。尽管效率很高,但由于与核酸酶诱导的 DSB 相关的缺点,这种“切割和修复”策略在临床环境中不太受欢迎。在这篇综述中,我们重点介绍了有助于应对这些挑战的最新进展,包括设计和发现具有改进功能的新型 CRISPR/Cas 系统以及开发无 DSB 的基因组编辑器。
基本编辑器的随机多重SGRNA组装的定向稻基因
基于CRISPR的摘要定向进化是一种有效的繁殖生物技术,可改善植物中的农艺特征。然而,使用单个单个指南RNA,其基因多样化仍然受到限制。我们在这里描述了多重的正交基础编辑器(MOBE),以及随机多重的SGRNA组装策略,以最大程度地提高基因多样化。bobe可以在不同的目标上诱导有效的正交安倍(<36.6%),CBE(<36.0%)和A&CBE(<37.6%),而SGRNA组装策略随机基础编辑各个目标上的基础编辑事件。与稻米乙酰辅酶A羧化酶(OSACC)的第34外显子的每个链中的130和84个靶标相应,我们观察到了随机双重双重和随机三重SGRNA库中的目标 - 折叠组合。我们使用MOBE和大米中的随机双重SGRNA文库进一步进行了OSACC的定向演变,并获得了更强的除草剂耐药性的单个或连接的突变。这些策略对于功能基因的原位定向演变很有用,并且可能会加速大米的性状改善。
全局量化揭示了碱基编辑器的大量低水平脱靶活动
碱基编辑器是专门设计的脱氨酶,能够以精确有效的方式定向转换基因组或转录组中的特定碱基,并有望纠正致病突变。限制这种强大方法应用的一个主要问题是脱靶编辑问题。最近的几项研究表明碱基编辑器会诱导大量脱靶 RNA 活性,并证明脱靶突变可能会被改进的脱氨酶版本或优化的向导 RNA 抑制。在这里,我们描述了一类新的脱靶事件,这些事件对于现有的检测基因组变异的方法来说是不可见的,因此迄今为止一直被忽视。我们表明,非特异性、看似随机的脱靶事件会影响整个基因组或转录组中的大量位点,并占脱靶活动的大多数。我们开发并采用一种对随机脱靶活动敏感的不同互补方法,并使用它来量化由于当前优化的脱氨酶编辑器而导致的大量脱靶 RNA 突变。我们提供了一种计算工具来量化全局脱靶活动,可用于优化未来的碱基编辑器。工程碱基编辑器能够以单碱基分辨率定向操纵基因组或转录组。我们相信,实施这种计算方法将有助于设计更具体的碱基编辑器。