XiaoMi-AI文件搜索系统
World File Search System在胃肠道中发现的细菌 DNA
1 硕士生,渔业研究所水产养殖和渔业研究生课程 – APTA/SAA,圣保罗,SP CAPES 奖学金获得者 isabelacmoia@gmail.com ²FAPESP 青年研究员,渔业研究所 – APTA/SAA,圣保罗,SP 3 鱼病预防和生物防治小组,马拉加大学微生物学系,西班牙; 4 渔业研究所 - APTA/SAA,圣保罗,SP *资金支持:圣保罗研究基金会 (FAPESP,流程:2014/15390-1)。
胃肠道间质瘤的免疫疗法
胃肠道间质瘤 (GIST) 是软组织肉瘤 (STS) 的一个亚型,已成为致癌成瘾和靶向治疗的概念。这些肿瘤中的绝大多数是在 KIT 或血小板衍生的生长因子受体 a (PDGFR a) 发生突变后发展起来的,导致不受控制的增殖。GIST 对伊马替尼高度敏感。GIST 在滤过性肿瘤中具有免疫力,以肿瘤相关巨噬细胞 (TAM) 和 T 细胞为主,包括许多 CD8+ T 细胞,其数量具有预后意义。基因组表达谱是 Th1 反应受到抑制以及三级淋巴结构和 B 细胞特征的存在,这些已知特征可预测对 ICI 的反应。然而,微肿瘤环境具有免疫抑制特性,具有免疫抑制性 M2 巨噬细胞、吲哚胺 2,3-双加氧酶 (IDO) 或 PD-L1 过度表达以及主要组织相容性复合体 1 型缺失。除了抑制 KIT 致癌基因外,伊马替尼似乎还通过促进细胞毒性 T 细胞活性、与自然杀伤细胞相互作用以及抑制 PD-L1 表达发挥作用。矛盾的是,伊马替尼似乎还会诱导巨噬细胞的 M2 极化。使用抗 CTLA-4 或抗 PD-L1 药物的免疫治疗试验很少,可用的临床数据并不十分乐观。基于对 TME 的全面分析,我们认为在 GIST 中必须强调三种免疫治疗策略。首先,必须根据已识别的驱动突变(如 PDGFR a D842V 突变)、三级淋巴结构 (TLS) 或 PD-L1 表达情况更好地选择临床试验中的患者。此外,创新的免疫治疗药物也引起了 GIST 的极大兴趣,并且在伊马替尼治疗期间疾病进展后探索 IDO 靶向治疗具有很强的理由。最后也是最重要的一点,将 c-kit 抑制与免疫检查点抑制剂相结合具有很强的理由。
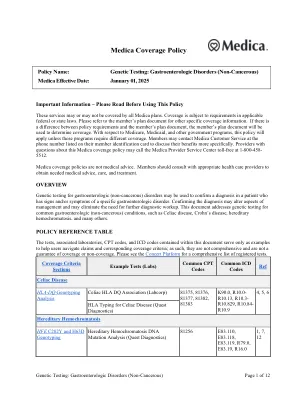
基因检测:胃肠道疾病(非...
重要信息 – 请在使用本政策前阅读 这些服务可能包含在所有 Medica 计划中,也可能不包含在内。 保险范围受适用联邦或州法律的要求约束。 有关其他具体保险信息,请参阅会员的计划文件。 如果政策要求与会员的计划文件存在差异,则将使用会员的计划文件来确定保险范围。 对于 Medicare、Medicaid 和其他政府计划,除非这些计划需要不同的保险范围,否则将适用本政策。 会员可以拨打会员身份证上列出的电话号码联系 Medica 客户服务部,以更具体地讨论他们的福利。 提供商如果对此 Medica 保险政策有疑问,可以拨打免费电话 1-800-458-5512 联系 Medica 提供商服务中心。 Medica 保险政策不是医疗建议。 会员应咨询适当的医疗保健提供商,以获得所需的医疗建议、护理和治疗。 概述
使用 U-Net 自动分割胃肠道
摘要 — 医学图像处理极大地改变了医疗保健的格局,特别是在各种疾病的诊断和治疗方面。胃肠道 (GI) 癌症已成为一个快速增长的问题,估计每年报告的新病例有 500 万例。为了达到这种精度,医疗保健专业人员现在利用尖端的磁共振成像 (MRI) 模式,即 MR-Linacs,它可以提供肿瘤位置的每日视图。然而,这一过程中的一个瓶颈出现在从获得的医学图像中手动分割处于危险中的健康器官(如胃和肠)的过程中。这项由放射科医生执行的任务非常耗时,可能会大大延长治疗时间,从而加剧患者的痛苦。因此,胃肠道分割的自动化可以无缝地帮助肿瘤学家。我们的研究提出了一种自动分割胃肠道的模型。本研究提出了一个 U-Net 模型,可以从 MRI 扫描中分割胃和肠。该数据集来自威斯康星大学麦迪逊分校卡博内癌症中心,包含用于训练注释的 RLE 编码掩码以及 16 位灰度 PNG 图像。每个病例包含多个扫描切片,按时间或整个病例分割。我们的方法使用了 U-Net 上的各种损失函数组合来提高胃肠道自动分割的准确性和效率。与其他损失函数相比,我们的模型使用 Dice+BCE 损失函数实现了较高的准确性。在训练数据集上,采用 Dice+BCE 损失函数的 U-Net 模型获得了最高的骰子分数 0.9082 和 IOU 分数 0.8594。在验证数据集上,该模型的骰子分数为 0.8974,交并比 (IoU) 分数为 0.8181。这项研究有助于解决与手动胃肠道分割相关的挑战,通过使用深度学习技术进行自动分割提供了可行的解决方案。关键词 — 磁共振成像 (MRI)、组合损失函数、U-Net、威斯康星大学麦迪逊分校 Carbone 癌症中心、胃肠道分割
约束应力相关的胃肠道损伤和...
abtract,应力与胃肠道(GI)疾病之间的关联已经很好地确定,而确切的机制仍然难以捉摸。因此,迫切需要建立小鼠模型来研究约束应力相关的GI泄漏,但是当前模型有其局限性。最近已经开发了一种新的埃文斯蓝色约束小鼠模型,该模型使研究人员能够研究活动物中的约束压力相关的GI泄漏。本评论文章将重点介绍该模型,包括其机制,临床意义以及研究约束压力相关的GI损伤的应用。使用该模型的研究的最新发现也将得到强调,以及它们的诊断和治疗潜力。本文旨在讨论当前的研究,并为进一步研究提供建议,最终提高我们对压力与胃肠道损伤之间的联系并改善患者结果的理解。
ME/ ... div>的胃肠道菌群
与其他感染一样,SARS-COV-2感染也会触发急性后感染综合征(PAIS),该感染通常会发展为肌肌脑膜炎/慢性疲劳综合征(ME/CFS)。ME/CFS是一种严重的多系统疾病,尚未建立特定的诊断标记或治疗概念。尽管有许多迹象表明了感染后神经系统,免疫学,内分泌和代谢偏差,但确切的原因和病理生理学仍然尚不清楚。迄今为止,数据很少,胃肠道菌群的组成和功能的变化已成为与免疫学和炎症途径相关的潜在影响变量,ME/CFS的变化。据推测,这种营养不良可能导致肠道屏障功能障碍,氧化应激增加的微生物成分的易位以及ME/CFS的发展或进展。在这篇综述中,我们详细讨论了有关胃肠道微生物群及其在ME/CFS中的微生物介体的改变的发现。批判性观察时,目前尚无证据表明微生物群的变化与ME/CFS的发展之间的因果关系。大多数研究都描述了定义较差的患者人群中的关联,通常结合了各种临床表现,例如肠易激综合征和与ME/CFS相关的疲劳。然而,利用与其他胃肠道疾病的类比,有可能制定旨在调节肠道菌群和/或其代谢物作为ME/CFS和其他PAIS的潜在治疗方法的策略。应在临床试验中进一步研究这些策略。
IL-37在胃肠道疾病中的作用
胃肠道粘膜表面经常受到挑战,因为它的表面积很大,最常见的是微生物的进入。IL-37,一种抗炎性细胞因子,调节局部和全身宿主免疫。 H.幽门螺杆菌感染会导致胃粘膜中IL-37的抑制作用,导致粘膜炎症炎症和破坏,从而促进幽门螺杆菌的增殖增加。 由于免疫失调,食物过敏也会导致胃肠道损伤。 另一方面,在胃癌患者中观察到的IL-37水平升高,与细胞和体液水平的宿主免疫保持降低,这表明IL-37可能通过抑制促促促进性反应有助于胃癌的发展。 虽然IL-37在IBD动物模型中提供了保护,但在IBD患者中检测高度生产的IL-37表明具有阶段依赖性作用,在急性炎症中具有保护性,但可能会加剧慢性条件下IBD的发展。 此外,CRC中的结肠IL-37升高与总生存时间和疾病时间相关,表明CRC中IL-37的保护作用。 上gi器官和下gi器官之间IL-37的差异调节和表达可能归因于微生物环的变化。 此信息表明IL-37可能是潜在的治疗剂,具体取决于阶段和位置。IL-37,一种抗炎性细胞因子,调节局部和全身宿主免疫。H.幽门螺杆菌感染会导致胃粘膜中IL-37的抑制作用,导致粘膜炎症炎症和破坏,从而促进幽门螺杆菌的增殖增加。由于免疫失调,食物过敏也会导致胃肠道损伤。另一方面,在胃癌患者中观察到的IL-37水平升高,与细胞和体液水平的宿主免疫保持降低,这表明IL-37可能通过抑制促促促进性反应有助于胃癌的发展。虽然IL-37在IBD动物模型中提供了保护,但在IBD患者中检测高度生产的IL-37表明具有阶段依赖性作用,在急性炎症中具有保护性,但可能会加剧慢性条件下IBD的发展。此外,CRC中的结肠IL-37升高与总生存时间和疾病时间相关,表明CRC中IL-37的保护作用。上gi器官和下gi器官之间IL-37的差异调节和表达可能归因于微生物环的变化。此信息表明IL-37可能是潜在的治疗剂,具体取决于阶段和位置。
肠道微生物组和胃肠道的疾病
“微生物”将非常小的思想与不断发展的生物体的思想融合在一起,是微生物学学科的统一原理。Our journal recognizes the broadly diverse yet connected nature of microorganisms and provides an advanced publishing forum for original articles from scientists involved in high-quality basic and applied research on any prokaryotic or eukaryotic microorganism, and for research on the ecology, genomics and evolution of microbial communities as well as that exploring cultured microorganisms in the laboratory.
针对胃肠道癌症的 HER-2 靶向治疗
2020 年,全球新诊断的胃肠道 (GI) 癌症(包括食管癌、胃癌、胆管癌、胰腺癌、结直肠癌和肛门癌)达 510 万例,癌症相关死亡人数达 360 万例 [1]。在新辅助、辅助和姑息治疗阶段,细胞毒性化疗一直是 GI 癌症全身治疗的主要手段。除了微卫星稳定的结直肠癌和胰腺癌外,几种 GI 癌症治疗方法的最新进展促使人们使用免疫疗法刺激先天免疫系统来靶向癌细胞 [2]。精准医疗方法也推动了 GI 癌症的治疗,针对基因型定义的患者亚群提供靶向治疗,其中最热门的是人表皮生长因子受体 2 (HER-2)。这越来越多地被视为与肿瘤无关的靶点。 HER-2 是一种受体酪氨酸激酶 (RTK) 跨膜蛋白,由 17 号染色体上的 HER-2 致癌基因编码。HER-2 属于四种蛋白组,其他四种蛋白包括 HER-1(也称为表皮生长因子受体 (EFGR))、HER-3 和 HER-4。HER-2 通过与 HER3 的同源二聚化或异源二聚化激活。一旦被激活,它会启动一系列细胞内信号传导,促进肿瘤发生 [3] 。HER-2 的表达首先通过免疫组织化学 (IHC) 评估,然后以 0-3 + 的评分报告。可能的结果包括未扩增 (IHC 0)、HER-2 低 (IHC 1 +)、