XiaoMi-AI文件搜索系统
World File Search System录用稿件,非最终出版稿 - 工程科学学报
因此,跨个体、跨场景的脑电分析方法逐渐成为研究热点。越来越多的研究人员将广泛应用脑 电信号分析的特征于跨个体、跨场景的脑电信号分析研究中。 Touryan 等人采用经典的独立成分分 析的特征分析方法描述特征空间,计算功率谱密度( Power Spectral Density , PSD ),并采用顺序 前向浮动选择方法识别频谱特征中的独立成分集,结果表明该方法可以识别出跨场景脑电信号中的 共同成分 [88] 。 Kakkos 等人采用了特征融合的方法,将 PSD 与功能连接特征相结合,提高了跨场景 分类的性能,并证明了脑特征融合在跨场景中的应用更为有效 [89] 。 Xing 等人将模糊熵特征用于跨 场景脑电信号分析,发现模糊熵特征相对于其他特征更能适合跨场景 [90] 。卷积神经网络 ( Convolutional Neural Networks , CNN )和递归神经网络( Recurrent Neural Networks , RNN )等基 于深度学习的新型跨任务模型在跨场景脑电分析中展现了巨大潜力。这些模型能够自动提取特征和 学习复杂的脑电特征,从而有效地缩小不同任务和场景之间的差距,提高模型的泛化能力 [91][92][93] 。 近年来,一些跨学科的方法被创新性地应用于跨场景研究, Zhao 等人提出了一种跨学科的对齐多 源域自适应方法,用于跨个体的 EEG 疲劳状态评估,显著提高了模型的泛化能力 [94] , Zhou 等人在 此基础上进行改进,提出了一种跨任务域自适应方法,有效提升了跨场景认知诊断的性能 [95] 。
补充材料脑脑内脑内...
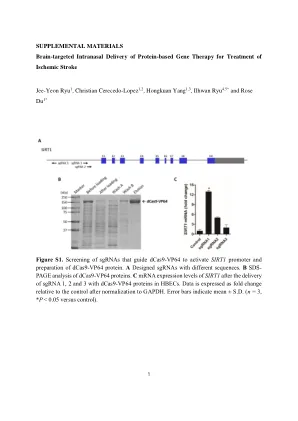
图S10。 建立用于研究缺血性中风的永久性脑动脉闭塞(PMCAO)模型。 PMCAO手术程序。 CCA,ICA和ECA暴露了,将硅细丝插入CCA和ICA直到到达MCA(有关详细信息的材料和方法)。 用biorender.com创建的数字。 b TTC染色大脑的代表性照片。 白色区域代表PMCAO的梗塞区域。 PMCAO后1、3和6小时,缺血性大脑中SIRT1的mRNA表达水平。 数据表示为折叠变化,相对于假手术组在归一化为GAPDH之后。 误差条表示平均值±S.D. (n = 3)(每组n = 10只小鼠, * p <0.05,*** p <0.001对假手术)。 缩写:CCA,常见的颈动脉; ICA,颈内动脉; ECA,外部颈动脉; MCA,中大脑中动脉; TTC,2,3,5-三苯基四唑氯化物。图S10。建立用于研究缺血性中风的永久性脑动脉闭塞(PMCAO)模型。PMCAO手术程序。CCA,ICA和ECA暴露了,将硅细丝插入CCA和ICA直到到达MCA(有关详细信息的材料和方法)。用biorender.com创建的数字。b TTC染色大脑的代表性照片。白色区域代表PMCAO的梗塞区域。PMCAO后1、3和6小时,缺血性大脑中SIRT1的mRNA表达水平。数据表示为折叠变化,相对于假手术组在归一化为GAPDH之后。误差条表示平均值±S.D.(n = 3)(每组n = 10只小鼠, * p <0.05,*** p <0.001对假手术)。缩写:CCA,常见的颈动脉; ICA,颈内动脉; ECA,外部颈动脉; MCA,中大脑中动脉; TTC,2,3,5-三苯基四唑氯化物。
全脑脑
全脑脑是复杂的大脑畸形,这是由于早期胎儿发育过程中大脑不完全的裂解而导致的。这种情况的特征在于普罗德龙(胚胎的前脑)的失败,以正确分成大脑半球的双叶,导致影响大脑和面部特征的异常。根据大脑分裂的严重程度,全脑脑分为四种类型:Alobar Holoporsencephaly:最严重的形式,其中没有脑半球分离,导致单个脑室心室和一个单裂脑。半月骨全脑脑:大脑半球部分分离,大脑的结构在某种程度上介于Alobar和Lobar之间。Lobar Holoporsencephaly:最少的严重形式,具有更好的脑半球分离和更正常的大脑结构。中半球间变体(syntelcephaly):半球在大脑中间没有分离,但可能在前和后方面更正常地分裂。是什么导致全脑脑?
将农田转化为可再生能源
“尽管《可持续地下水管理法案》和 SB 100 的目标和时间表是分开构思的,但它们却具有重要的协同作用。知情、协调的政策实施可以造福加州的能源消费者,同时支持该州经济最困难地区之一的经济稳定。根据 SGMA,大多数山谷 GSA 需要在 2040 年前实现其盆地的可持续管理,但减少地下水需求的项目和行动(主要是通过闲置或退耕)需要在此之前开始。同样,为了在 2045 年前实现 100% 可再生和零碳电力的目标,山谷的开发项目需要提前很久进行规划、许可和安装。”
一般转诊 DNA 检测
处理个人数据:SKK 存储个人数据是为了履行与您的关系。通过提交您的个人数据,您同意 SKK 存储和处理这些数据,部分是为了履行协议,部分是以 SKK 的合法利益作为法律依据。所有个人数据均按照当时有效的法律进行处理。有关 SKK 处理个人数据的详细信息,请访问 www.skk.se/pub。该信息可能会被用于直接营销和发送 SKK 的信息。如果您不想收到这些邮件,您可以通过联系我们的会员部门取消订阅,电话:08-795 30 50,medlem@skk.se。有关 SKK 使用个人信息的详细信息,请访问 www.skk.se/pub-en。
转换对医生意味着什么
Lee Health 457(b)退休储蓄计划:转换将作为合格活动,使员工可以过渡现有457(b)计划资金成为替代投资工具(例如401K或IRA)。No 457(b)计划资金将在转换时面临风险。团队正在评估替代补充退休福利选择。
DNO 转换为 DSO
额外的测量设备和数据分析解决方案将首先部署到传统用途发生最重大变化的地区,或我们预测 LCT 会大量使用(如电动汽车、太阳能电池板或热泵)的地区。额外的设备将使我们能够优化网络拓扑并在网络中创建容量以适应不断变化的用途。创新的技术和商业解决方案将使我们能够继续为当前和未来的客户提供高效、协调和经济的网络。它将使我们能够最好地满足新兴系统需求,与邻近的 DSO 协调并更好地与国家传输网络连接。