XiaoMi-AI文件搜索系统
World File Search System干细胞疗法的骨科应用,包括与自体骨髓一起使用的骨替代物
注意:如果程序或设备缺乏有关安全性和功效的科学证据,因为它是研究或实验性的,则该服务是不合理的,并且是治疗疾病或伤害的必要条件。(Medicare IOM Pub。编号100-04,ch。23,§30a)。根据《社会保障法》第XVIII条,§1862(a)(1)(a),医疗保险仅涵盖了医学合理和必要的服务。在没有NCD,LCD或其他覆盖范围指南的情况下,CMS指南允许Medicare Advantage组织(MAO)根据权威证据进行覆盖范围,应用基于客观的,基于证据的过程。(Medicare IOM Pub。编号100-16,ch。 4,§90.5)。 Medicare Advantage医疗政策 - 医学政策号 M-149-提供有关该计划的证据评估过程的更多详细信息(请参见交叉参考)。100-16,ch。4,§90.5)。Medicare Advantage医疗政策 - 医学政策号M-149-提供有关该计划的证据评估过程的更多详细信息(请参见交叉参考)。
成人 HSCT 建议 - 开放政府计划
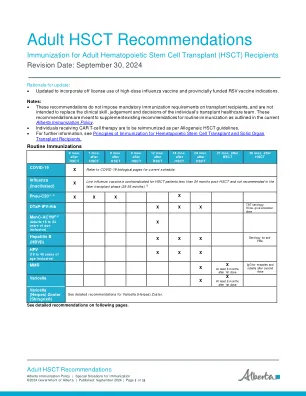
需要注射 2 剂,间隔 2 至 6 个月。自体(来自同一个人 – 捐赠者和接受者和是同一个体)对于 18 岁以上的个人,无论是否有水痘病史,建议在自体移植后 6 个月接种 Shingrix®。(1)个人接受抗病毒药物治疗时可以接种 Shingrix。自体移植后 Shingrix® 的随机试验表明,保护作用持续,无需接种水痘疫苗。(1,10)省级资助的免疫接种计划为移植后 6 个月开始的自体接受者提供 Shingrix®。注意:对于在 HSCT 后接种过一剂水痘疫苗的自体个体,应在第一剂后至少三个月接种第二剂水痘疫苗。•对于这些个体,建议在自体 HSCT 后 36 个月,按照 50 岁及以上的一般免疫功能正常人群接种 Shingrix®。 (1)
心肌梗死后经心内膜注射扩增自体 CD34+ 细胞:EXCELLENT 试验的设计
1 法国图卢兹图卢兹大学医院心脏病学系,心脏医学研究所,临床生物治疗研究中心 1436,INSERM I2MC 1297;2 法国蒙彼利埃蒙彼利埃大学医院心脏病学系;3 法国斯特拉斯堡中央医院公共卫生中心 GMRC;4 意大利米兰 Monzino IRCCS 心脏病学中心血管生物学和再生医学科;5 意大利米兰大学生物医学、外科和牙科科学系;6 法国佩萨克 Haut-Leveque 医院介入心脏病学和重症监护系;7 法国米卢斯 CellProthera;8 法国卡昂大学医院心脏病学系; 9 诺曼底大学核医学系,UNICAEN,CHU de Caen Normandie,法国卡昂; 10 核医学和 Nancyclotep 实验平台,CHRU-Nancy,洛林大学,南锡,法国; 11 西奈山富斯特心脏医院,西奈山伊坎医学院,纽约州,美国; 12 哈佛医学院布莱根妇女医院心血管科,美国马萨诸塞州波士顿; 13 法国巴黎 Pitié- Salpêtrière 医院心脏病科; 14 英国心脏基金会卓越研究中心,爱丁堡大学,英国爱丁堡; 15 洛林大学,Inserm,Centre d ' Investigations Cliniques Pluithématique 1433,Centre Hospitalier Régional Universitaire de Nancy,南锡,法国
FEP 7.01.48自体软骨细胞植入用于焦点关节软骨病变
制定了FEP医疗政策手册中包含的政策,以协助管理合同福利,并且不构成医疗建议。他们无意代替或代替从业人员或其他医疗保健专业人员的独立医疗判断。Blue Cross和Blue Shield协会不打算由FEP医疗政策手册或任何特定的医疗政策,建议,倡导,鼓励或劝阻任何特定的医疗技术。与医疗技术相关的医疗决定应与成员/患者与其医疗保健提供者协商时严格做出。在医学上有必要的特定服务或供应的结论并不构成蓝十字和蓝盾服务福利计划涵盖(或支付)本服务或特定成员供应的代表或保证。
多发性骨髓瘤患者的自体干细胞移植(4; 14):MD Anderson癌症中心经验
结果:包括79名患者,中位年龄为60岁(范围:32-78),男性为52%。四十四(56%)患者患有额外的HR细胞遗传学异常。在自动HCT之前获得≥VGPR的五十名患者(63%),而20例(25%)的残留疾病(MRD)阴性≥VGGPR。最多可以在移植后评估中分别90%和63%的VGPR和MRD阴性≥VGPR。幸存者的中位随访时间为35.7(范围7.7-111.6)月。整个队列的PFS和OS分别为22.9个月和60.4个月。移植前MRD阴性≥VGPR患者在单变量分析(UVA)和多变量分析(MVA)中的PFS和OS有所改善(MVA):( HR [95%CI] 0.35 [0.16-0.76],P = 0.008),P = 0.008)和(0.12 [0.12 [0.12 [0.03-0.44],PFA),p。存在其他高风险的细胞遗传学异常与下pF(p = 0.57)或OS(P = 0.70)无关。转移后的Lenalidomide的组合与UVA和MVA中的OS相关(0.14 [0.04-0.45],P = 0.001),而其对PFS的影响并不具有统计学意义(P = 0.37)。
干细胞疗法的骨科应用,包括与自体骨髓一起使用的骨替代物
缺乏降低癌症死亡率筛查的直接证据,筛查测试评估的关键参数是诊断性能特征(即,与标准标准,拟议的频率和筛选频率以及测试结果的随访管理相比,诊断性能特征(即灵敏度,特异性,正和负预测值)。已经建立了使用结肠镜检查作为标准标准的标准,已建立了当前接受的筛查选项的诊断性能特征(即粪便隐匿血液测试[FOBT],FECAL免疫化学测试[FIT],柔性Sigmoid Scoscopicy,Double Submoid Scoscopicy,Double Dobles contrast Subium Enema)。对某些筛查方式的建模研究和临床试验证据使人们对当前建议的癌症筛查方式的有效性有信心。
自体成骨细胞的邻接是否可以改善早期股骨骨坏死的核心减压结果?双盲,
这项工作得到了骨治疗SA(目前是BioseNic SA)的支持,该研究参与了研究和分析的各个阶段,并涵盖了与开发和发表本文相关的成本。与修订的开发有关的成本由伊拉斯士医院涵盖。在研究期间,其中一位作者(MJ)证明了个人付款或收益,收到了Medacta International的10,000美元至100,000美元。在研究期间,一位或多个作者(MJ)的机构已从骨治疗学付款。在研究期间,一位作者(TT)证明了个人付款或有益的收据,其金额低于骨治疗剂,Amgen,Amgen,Arrow,Biogen,Biogen,Chugai,Grunenthal,Grunenthal,Jansen,Jansen,LCA,LCA,Lilly,Lilly,MSD,Norordic,Novartis,Novartis,sanoas,thuas,Sanoas,thuas,thu.thus and thu。在研究期内,更多的院子机构(kpg)已从骨治疗学,Zimmer Inc,Waldemar Link GmbH和Co KG和Aesculap AG中获得。一位作者(KPG)证明了个人付款或收益,即在Thestudyperiod期间,Inanamountofusd10,000,000,000,000,000,000,000 fromaesculapagandreimbursementfromzimmerbiommerbiommmerbiomet(教育事件)。在研究期间,一个或多个作者(OG和WS)是骨治疗的雇员。在研究期间,其中一位作者(BVB)证明了个人付款或收益,从骨疗法和诺瓦迪普获得了10,000至100,000美元的金额。该研究在http://www.clinicaltrials.gov(NCT01529008)上进行了注册。所有ICMJE对作者,临床骨科和相关研究®编辑和董事会成员的利益形式的冲突都与该出版物有关,并且可以根据要求查看。这项研究的伦理批准是从比利时布鲁塞尔的Cub-ulb Erasme获得的(BE01)。德国库尔恩大学(DE02); Chu Saint-Etienne - Comit´e Dey Protection des venses Sud-est 1,法国(FR01); NRES委员会伦敦 - 英国西伦敦和GTAC(UK01);和中心委员Mensgebonden Onderzoek,荷兰(NL01)。这项研究的伦理批准是从比利时布鲁塞尔的Cub-ulb Erasme获得的(BE01)。德国库尔恩大学(DE02); Chu Saint-Etienne - Comit´e Dey Protection des venses Sud-est 1,法国(FR01); NRES委员会伦敦 - 英国西伦敦和GTAC(UK01);和中心委员Mensgebonden Onderzoek,荷兰(NL01)。10在布鲁塞尔比利时:布鲁塞尔的楚圣皮埃尔;默克斯姆(Merksem)很少。南希Chu Amense-他的南部医院Amense; AnnastiftTift,汉诺威; Urzburg;格雷夫斯瓦尔德(Greifswald)的正骨; GmbH是Waldkrankenhaus。大型医院。
成功的自体造血干细胞移植在难治性抗Caspr1抗体淋巴结中
1神经学系,神经中心,瑞士锡安,瑞士2号,瑞士2临床神经科学系,洛桑大学(CHUV)大学医院和洛桑大学,瑞士洛桑大学,瑞士大学3号,洛桑血液学系3疾病和ALS,LA TIMONE医院,法国Marseille,5个部门和神经病学实验室,国家参考“稀有周围神经病”,Limoges大学医院(CHU LIMOGES),法国Limoges,6 Institut degénomiquefoncountionnelle,Montpellier,cnrander,cnrander,cnrance cnrance in Insermer,Insermermermer,Montermer,Montermer,Montermer,Montermenter,Insermermenter,Montermermen
同种异体手移植或自体手再植后初级躯体感觉皮质的变化
接受同种异体手移植或自体手再植(统称“手部修复”)的截肢者提供了一个独特的机会来测量失神经系统后可塑性变化的范围,特别是初级躯体感觉皮层(S1)。然而,这样的病人很少,之前的研究将个案与小群典型成年人进行了比较。在这里,我们研究了 5 个个体(n = 8 个疗程:一个移植手术进行了 2 个疗程,一个移植手术进行了 3 个疗程,三次再植手术各进行了 1 个疗程)。我们使用功能性磁共振成像(fMRI)来测量 S1 对传递到每个病人左右指尖和下脸部的受控气动触觉刺激的反应。这些数据与从典型成年人(n = 29)和当前单侧截肢者(n = 19)获得的反应进行了比较。在刺激患手期间,患者患侧 S1(患手的对侧)对刺激的反应方式与截肢者和典型成年人相似。对侧反应的存在表明 S1 功能大致典型,但反应普遍处于典型变异范围的低端。患者患侧 S1 对完整手部刺激的反应表现出很大的个体差异:虽然所有患者都属于典型成年人的范围,但一些患者(4/8)的同侧反应与当前截肢者表现出的类似。与手部修复患者不同,当前截肢者与典型成年人相比表现出明显的 S1 重组,包括对完整手部刺激的双侧 S1 反应。在所有三个参与者组中,我们通过测量个体识别手掌和手指触摸位置的能力来评估触觉定位。奇怪的是,虽然移植患者的触觉定位能力随着时间的推移有所改善,但这与 S1 对触觉刺激的反应变化无关。总体而言,我们的研究结果首次描述了手部修复后皮质对良好控制的触觉刺激的反应。我们的案例研究表明,手
高风险同种异体或自体BMT或白血病患者的病毒呼吸道感染的诊断和管理
Contents Scope ..................................................................................................................................................... 2 1.Introduction ................................................................................................................................ 2 1.1.High-risk criteria ........................................................................................................................ 2 2.Diagnosis .................................................................................................................................... 2 2.1.Samples ................................................................................................................................... 2 2.2.Investigations ............................................................................................................................ 2 3.Minimising infection spread ...................................................................................................... 3 3.1.Inpatients .................................................................................................................................. 3 3.2.Inpatient visitors/relatives .......................................................................................................... 3 3.3.Outpatients ............................................................................................................................... 3 3.4.Staff .......................................................................................................................................... 3 3.5.Staff illness ............................................................................................................................... 4 3.6.Environment or equipment ........................................................................................................ 4 4.Management ............................................................................................................................... 4 4.1.Respiratory Syncytial Virus (RSV)........................................................................................ 4 4.2.Investigations ............................................................................................................................ 4 4.3.Treatment criteria ...................................................................................................................... 4 4.4.Treatment algorithm .................................................................................................................. 5 4.5.Immunoglobulin for RSV – post BMT patients only ................................................................... 5 4.6.Ribavirin (unlicensed) ............................................................................................................... 6 4.7.Influenza A & B ...................................................................................................................... 7 4.8.Investigations ............................................................................................................................ 7 4.9.Treatment ................................................................................................................................. 7 4.10.Parainfluenza (HPIV) ............................................................................................................. 7 4.11.Parainfluenza的免疫球蛋白 - 仅BMT后患者................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................... 7 4.12。Adenovirus ............................................................................................................................. 8 4.13.Cidofovir (micro approval required) ....................................................................................... 8 4.14.SARS-CoV-2 ........................................................................................................................... 9 References ............................................................................................................................................ 9 Original authors .................................................................................................................................. 10 Audit .................................................................................................................................................... 10 Circulation ........................................................................................................................................... 10 Review ................................................................................................................................................. 11