XiaoMi-AI文件搜索系统
World File Search System赫特福德郡和西埃塞克斯成人(年龄≥18岁...
对于未经胰岛素的治疗方案的2型糖尿病患者 - 绿色•请参阅“ 2型糖尿病患者(T2DM)”部分,以获取其他考虑因素。适用于具有胰岛素 - 琥珀色启动的治疗方案的2型糖尿病患者•社区或二级护理糖尿病专家团队的启动。•具有专业糖尿病利益或接受相关培训的初级保健专业人员可能会发起。对于非糖尿病性CKD蛋白尿患者 - •绿色 - 建议与NICE TA775和TA942一致的患者启动初级保健,但琥珀色开始下提到的那些病例。•琥珀色启动 - 肾脏科专家启动Dapagliflozin或empagliflozin属于以下类别的患者(因为没有大型随机对照试验的数据) - 这些同胞的大型随机对照试验) - 在专业启动后继续进行:
未来食物脂质的生物技术
- 葡萄糖共转运蛋白-2抑制剂(SGLT2抑制剂)是抗糖尿病药物的原始发展,其中心血管(CV)结局试验证明了2型2型糖尿病(T2D)患者的CV结果改善。对简历结果试验和后来专用的肾脏结果试验的次要分析始终报道了与肾脏相关的外部改善的,与T2D状态无关,以及一系列肾脏功能和蛋白尿。重要的是,SGLT2抑制剂通常是安全且良好的,进行了临床试验和现实分析,表明急性肾脏损伤的风险降低。SGLT2抑制剂的肾脏保护作用通常遍及该类别的不同成员,可能是基于血液动力学,代谢,抗炎和抗纤维化机制的。在这篇综述中,我们总结了SGLT2抑制剂对不同患者种群肾脏结局的影响。
SMC2676 IPTACOPAN硬胶囊(Fabhalta®)Novartis ...
阵发性夜间血红蛋白尿症(PNH)是一种罕见的,威胁生命的疾病,可能影响任何年龄的人,尽管通常在年轻人中最常见于30年代和40多岁的年轻人。由于在磷脂酰肌醇聚糖A(PIG-A)基因中获得的突变而发生,因此导致了至关重要的末端补体抑制剂在细胞表面上的缺乏。在血细胞中缺乏这些蛋白质会触发不受控制的替代补体激活,这可能导致血细胞过早破坏(溶血症),溶血性贫血,血栓形成,最终导致死亡。PNH中的溶血分别以两种形式发生:在血管内(IVH)或血管外部(EVH)。IVH可以导致血栓形成,在补体抑制剂可用性之前,这是PNH患者死亡的主要原因。2,3
lupkynis(voclosporin)
lupkynis是一种口服钙调蛋白抑制剂(CNI)免疫抑制剂,在结构上与环孢素A结构相似。它在2021年获得了FDA的批准,用于治疗活性狼疮肾炎(LN),并结合背景免疫抑制治疗。ln是全身性红斑狼疮(SLE)的并发症,可以发展为终结阶段肾脏疾病(ESRD)。蛋白尿通常是LN的第一个迹象,这是通过尿蛋白肌酐比率(UPCR)升高的。通过肾脏活检证实诊断,该肾脏活检揭示了疾病的分类,并用于指导治疗。给药基于估计的肾小球过滤率(EGFR),大多数患者可能处于剂量范围的高端。高血压是一种常见的副作用,建议进行血压监测。lupkynis(voclosporin)在满足以下标准时将考虑覆盖:
近端小管缩短对Lowe综合征模型中蛋白质排泄的影响
底物是内吞作用的主要调节剂,预计LS LS患者的LMW蛋白尿是由于PT顶端内吞途径沿PT的某些有效功能所致。3与此相一致,培养细胞模型中的一部分研究表明,OCRL在内吞回收中起作用,这是通过防止在内吞囊泡上积累的肌动蛋白涂层的解聚和/或回收箱的作用。4,5但是,OCRL在细胞稳态中也具有许多其他角色,包括睫状生物发生,6-8细胞极性和自噬。6,9,10此外,OCRL在细胞因子期间被招募到脱落部位。11 ptdins(4,5)p 2累积稳定在细胞因子过程中的细胞内桥,并且其通过OCRL的水解对于脱落是必要的。11尚不清楚这些功能如何促进LS病理学。另一个未解决的问题是,OCRL的损失如何损害LS患者的Ca 2+,HCO 3 2和氨基酸的PT恢复。近年来已经开发了LS的小鼠和斑马鱼模型,但是在细胞培养中观察到的分子和细胞缺陷与患者和动物模型的表型之间的联系仍然难以捉摸。缺乏OCRL的转基因斑马鱼表现出降低的巨蛋白水平,降低了流体相位标记物的上升水平,除了与LS患者观察到的患者一致的眼睛和面部缺陷外,促脑肾脏PT中的亚皮囊泡较少。8,12小鼠LS模型的开发更为复杂。 这些8,12小鼠LS模型的开发更为复杂。这些OCRL敲除(KO)小鼠没有明显的表型,因为它们表达了高水平的Inpp5b,这是另一种磷脂酰肌醇5 9-磷酸酶,显然可以对某些OCRL功能进行操作。13 - 15小鼠PT中的inpp5b在较高水平和与人类相比的剪接变体中表达不同。16由于小鼠中的OCRL和INPP5B的全局KO是致命的,因此通过跨越OCRL KO小鼠的OCRL KO小鼠产生了17,18 LS小鼠模型,该小鼠过表达人Inpp5b与小鼠INPP5B KO:由此产生的雄性小鼠在年龄的8周时表现出适中的蛋白尿和氨基尿症。19,20已描述了一个最近的小鼠模型,其中在OCRL KO小鼠的肾脏中有条件地灭活了INPP5B。这些小鼠中的21个PT细胞表达了巨蛋白水平降低,并且表现出严重受损的内吞作用。令人惊讶的是,在KO之后没有立即观察到蛋白尿,而是需要几个月的发展。此时间滞后与OCRL对内吞途径功能的直接影响不一致,并表明在更长的时间段内发生的其他变化与LS表型相关。此外,需要靶向OCRL和INPP5B以观察任何肾脏表型,这是努力确定OCRL在Pt功能中的特定作用的努力。为了研究OCRL的损失如何影响PT功能,我们产生了PT细胞中LS的慢性CRISPR/CAS9 OCRL KO和LS的急性siRNA敲低模型。引人注目的是,在我们的所有模型中以及在患者纤维细胞中,我们观察到功能性OCRL的损失延长了细胞分裂的持续时间,并导致了多核细胞的积累。
评估恩格列净对 2 型糖尿病合并高甘油三酯血症患者血清甘油三酯和胆固醇水平的影响:一项前瞻性研究
摘要 目的:钠-葡萄糖协同转运蛋白-2 (SGLT2) 抑制剂除了降低血糖外,还可以改善脂质组。本研究检查了 SGLT2 抑制剂恩格列净如何影响患有高甘油三酯血症的 2 型糖尿病 (T2DM) 患者的甘油三酯。材料和方法:这项前瞻性研究于 2020 年在伊朗霍拉马巴德的 Shahid Rahimi 医院内分泌诊所进行。采用方便抽样法纳入了 38 名患者。从临床医疗档案中收集患者信息,包括年龄、性别、体质指数 (BMI)、空腹血糖 (FBS)、糖化血红蛋白 (HbA1c)、餐后 2 小时血糖、血清甘油三酯、总胆固醇、高密度脂蛋白 (HDL)、低密度脂蛋白 (LDL)、血清胰岛素水平、血清肌酐天冬氨酸氨基转移酶 (AST)、丙氨酸氨基转移酶 (ALT)、血压和尿白蛋白,并使用 SPSS 软件版本 22 中的配对 t 检验进行比较。结果:使用恩格列净治疗后,BMI、微量白蛋白尿、BUN、FBS、餐后 2 小时血糖和 HbA1c 均显着改善(P <0.05)。血脂方面,恩格列净治疗后甘油三酯、胆固醇、LDL水平明显改善(P<0.05),HDL水平升高,但差异无统计学意义,HbA1c与HDL(P=0.183)或甘油三酯(P=0.947)水平无线性相关性。结论:恩格列净除具有降糖作用外,还可改善2型糖尿病患者的甘油三酯和胆固醇水平,降低BMI、血压、BUN、微量白蛋白尿。关键词:2型糖尿病、血脂异常、钠-葡萄糖协同转运蛋白2抑制剂、恩格列净
相关并发症。基于寄存器的队列研究
抽象目的是评估1型糖尿病(T1D)/2型糖尿病(T2D)和牙周炎之间的关联,并评估牙周炎对糖尿病相关并发症的影响。设计观察性研究;登记数据的纵向分析。将瑞典初级保健中心,医院和牙科诊所设置为全国医疗保健登记册(2010- 2020年)。参与者28801个患有T1D的人(13 022名女性;平均年龄42岁)和57 839名没有糖尿病的人(非T1D; 26 271妇女;平均年龄43岁)。251 645个患有T2D的人(110 627名妇女;平均年龄61岁)和539 805个没有糖尿病的人(非T2D; 235 533妇女;平均年龄60岁)。糖尿病和非糖尿病组的年龄,性别和居住县匹配。主要结局措施普遍存在牙周炎,糖尿病相关并发症(视网膜病,蛋白尿,中风和缺血性心脏病)和死亡率。结果牙周炎在T2D(22%)中比非T2D(17%)更为常见。年龄段的差异较大(在30-39岁的调整后1.92; 95%CI 1.81至2.03),血糖控制差会加剧。牙周炎患病率为13%,非T1D的患病率为11%;只有血糖控制不良的亚组的牙周炎风险较高。Periodontitis was associated with a higher incidence of retinopathy (T1D: HR 1.08, 95% CI 1.02 to 1.14; T2D: HR 1.08, 95% CI 1.06 to 1.10) and albuminuria (T1D: HR 1.14, 95% CI 1.06 to 1.23; T2D: HR 1.09, 95% CI 1.07 to 1.11).结论T2D与牙周炎之间的关联很强,并且由于血糖控制差而加剧。牙周炎与T1D/T2D中中风,心血管疾病或较高死亡率的较高风险无关。对于T1D,牙周炎的关联仅限于具有不良血糖控制的亚组。牙周炎在T1D和T2D中导致视网膜病变和蛋白尿的风险增加。
阶段3,随机,双盲,安慰剂对照试验
1医院,阿根廷布宜诺斯艾利斯市Británicode Buenos Aires 2英国莱斯特莱斯特大学3哥伦比亚大学3哥伦比亚大学欧文医学中心,美国美国4阿拉巴马州伯明翰大学,伯明翰大学,伯明翰大学,美利坚合众国伯明翰大学,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国,美国。澳大利亚悉尼新南威尔士州简介:IGA肾病(IGAN)是原发性肾小球肾炎的主要原因,治疗方案有限。Zigakibart(Bion-1301)是一种新型的人源性单克隆抗体,可阻断4月份(一种诱导增殖的配体),这是一种igan患者的细胞因子。四月促进了致病性半乳糖缺陷型IgA1(GD-IGA1)的产生,从而导致免疫复合物的形成和肾小球沉积,从而导致炎症和肾脏损伤。用Zigakibart阻止4月是一种潜在的治疗Igan疾病的方法。在IGAN患者(NCT03945318)患者的Zigakibart的1/2期试验中,表现出GD-IGA1的快速且持久的降低,并且具有可接受的安全性,蛋白尿中持续有意义,临床上有意义的降低。 方法:超越是一个正在进行的第3阶段,随机,双盲,安慰剂对照试验,以评估Zigakibart对原始IGAN的成年人的影响,其渐进肾功能损失的风险。 将在北美,南美,欧洲和亚太地区大约272名患者入学。 患者将被随机分配1:1,以接受皮下600 mg Zigakibart Q2W或安慰剂104周。表现出GD-IGA1的快速且持久的降低,并且具有可接受的安全性,蛋白尿中持续有意义,临床上有意义的降低。方法:超越是一个正在进行的第3阶段,随机,双盲,安慰剂对照试验,以评估Zigakibart对原始IGAN的成年人的影响,其渐进肾功能损失的风险。将在北美,南美,欧洲和亚太地区大约272名患者入学。患者将被随机分配1:1,以接受皮下600 mg Zigakibart Q2W或安慰剂104周。关键资格标准包括过去10年内证实的活检IGAN(不是由于次要原因),EGFR≥30ml/min/min/1.73m 2(CKD-EPI)(CKD-EPI)和总尿液蛋白≥1.0g/day筛选时和UPCR≥0.7g/g。患者必须在筛查或不耐受RASI前至少12周内在最大耐受剂量的RAS抑制剂(RASI)上保持稳定。患者在筛查前至少12周也可能患有稳定剂量的SGLT2I,盐皮质激素受体拮抗剂和/或内皮素受体拮抗剂。该研究包括一个为期6周的筛查期,104周的双盲治疗以及24周的安全随访期。随机分组将按区域(亚洲与世界其他地方),基线蛋白尿(≥2g/day vs. <2 g/day)和EGFR(≤45ml/min/min/1.73m 2 vs.> 45 ml/min/min/min/1.73m 2)进行分层。附加
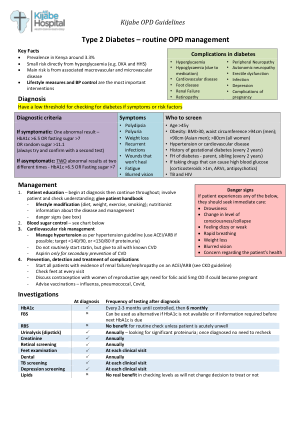
2 型糖尿病 – 常规门诊管理
诊断时 诊断后的检测频率 HbA1c P 每 2-3 个月一次,直至得到控制,然后 6 个月一次 FBS O 如果没有 HbA1c 或在下次 HbA1c 检测前需要信息,可以作为替代方案 RBS O 除非患者严重不适,否则常规检查没有好处 尿液分析(试纸) P 每年一次——寻找明显蛋白尿;一旦确诊无需重新检查 肌酐 P 每年一次 视网膜筛查 P 每年一次 足部检查 P 每次临床就诊时 牙科 P 每年一次 结核病筛查 P 每次临床就诊时 抑郁症筛查 P 每次临床就诊时 脂质 O 检查水平没有实际好处,因为不会改变是否治疗的决定
细胞串扰在糖尿病肾病进展中的作用
糖尿病性肾病(DN)是糖尿病最常见的并发症之一,其主要表现是进行性蛋白尿和肾功能异常,最终发展出终阶段肾病(ESRD)。DN的发病机理是复杂的,涉及许多信号通路和分子,包括代谢性疾病,遗传因素,氧化应激,炎症和微循环异常策略。随着医学实验技术的开发,例如单细胞转录组测序和单细胞蛋白质组学,肾细胞相互作用引起的病理改变吸引了越来越多的注意力。在这里,我们回顾了肾细胞之间串扰的特征和相关机制,在DN的发育和进展过程中,肾细胞足细胞,内皮细胞,膜细胞,周膜细胞,周细胞和免疫细胞的特征和相关机制,并突出了其潜在的治疗效应