XiaoMi-AI文件搜索系统
World File Search SystemPhosSTP – 磷酸酶抑制剂鸡尾酒片剂
简介 许多生物过程和途径的调节都是通过磷酸酯的形成和裂解来实现的。蛋白质的磷酸化通过蛋白激酶和磷酸酶的相互作用而精心平衡。为了了解这些途径,制药行业和研究机构目前正在开展大量科学工作。实现这一目标的重要一步是准确了解一般或特定的磷酸化状态,这需要保留磷酸化模式。
体外和计算机研究
进行了本研究,以研究c-大环亚钠肽(C-ANP 4-23)对人脂肪衍生的干细胞在10天内分化为脂肪细胞的人(1 m m m m)。在存在或不存在C-ANP 4-23的情况下,分别通过QRT-PCR和Western印迹确定了细胞内cAMP,CGMP和蛋白激酶A水平的水平,分别通过QRT-PCR和Western印迹确定蛋白质表达。还确定了脂解和葡萄糖摄取的水平。c-ANP 4-23治疗显着增加了细胞内cAMP水平和葡萄糖转运蛋白4型(GLUT4)和蛋白激酶的基因表达,AMP激活,α1催化亚基(AMPK)。Western印迹显示GLUT4和磷光体A水平的显着增加。重要的是,腺苷酸环化酶抑制剂SQ22536废除了这些影响。此外,C-ANP 4-23增加了葡萄糖摄取2倍。我们的结果表明,C-ANP 4-23增强了葡萄糖代谢,并可能有助于开发基于肽的新代谢疾病疗法。©2016 Elsevier Ireland Ltd.保留所有权利。
MKP1通过通过LKB1核保留抑制AMPK活性来促进非酒精性脂肪性肝炎
非酒精性脂肪性肝炎(NASH)是由肝细胞死亡通过caspase 6的激活而触发的,这是由于腺苷一磷酸腺苷(AMP)激活的蛋白激酶-Alpha(AMPKα)活性的降低而引起的。增加的肝细胞膜死亡会促进肝纤维化的炎症。我们表明,在纳什患者和纳什饮食中喂养的雄性小鼠中,核定定位的有丝分裂原活化蛋白激酶(MAPK)磷酸酶-1(MKP1)上调。这项工作的重点是研究MKP1是否以及如何参与NASH的发展。在NASH条件下增加氧化应激,诱导MKP1表达,导致核p38 MAPK去磷酸化并减少肝激酶B1(LKB1)磷酸化,以促进LKB1核出口所需的位点。nash饮食中MKP1的肝缺失喂养雄性小鼠将核LKB1释放到细胞质中,以激活AMPKα并防止肝细胞死亡,炎症和NASH。因此,需要核定定位的MKP1- P38 MAPK-LKB1信号传导才能抑制触发肝细胞死亡和NASH发展的AMPKα。
癌症治疗中的靶向激酶
印度马哈拉施特拉邦贝尔赫萨玛斯药学院药理学系 摘要:癌症可以看作是一组以细胞异常生长、侵入邻近组织甚至远处器官的能力以及如果肿瘤进展到超出可能范围则可能导致患者死亡为特征的疾病。癌症治疗包括化疗、基因治疗、手术、放射治疗以及根据疾病严重程度将这些治疗组合使用。小分子激酶抑制剂最近已在癌症的临床治疗中得到成功证明。自 1980 年代初首次暴露蛋白激酶以来,已有 37 种激酶得到抑制或获得 FDA 批准用于治疗乳腺癌和肺癌,多达 150 种激酶靶向药物和许多激酶特异性抑制剂处于临床试验阶段。正处于药物开发的临床前阶段。到 2023 年,将有 80 种小分子蛋白激酶抑制剂获得 FDA 批准。本综述概述了激酶靶向药物,并概述了激酶靶向癌症治疗的挑战和未来机遇。
癌症中的蛋白质磷酸化:揭开信号通路
发现蛋白激酶在癌症形成和进展中发挥关键作用的发现引发了人们的极大兴趣,并激发了人们对开发有针对性治疗的信号通路的强烈研究,并鉴定了预后和预测性生物标志物。尽管大多数努力都集中在酪氨酸激酶抑制剂(TKIS)和酪氨酸激酶受体(RTK)的靶向抗体,但也针对丝氨酸/苏氨酸激酶和蛋白质磷酸酶。不幸的是,抑制剂通常缺乏特定的牙齿,并影响各种激酶。此外,经过治疗的肿瘤获得耐药性和复发性,需要二线治疗。随着精确医学的出现,很明显,网络比单个蛋白质和基因更强大。药物开发正在转向动态信号网络靶向。在后基因组时代,翻译后的修饰,例如蛋白质磷酸化及其如何影响活动或网络结构的理解仍然很差。本期专门针对癌症中蛋白质磷酸化途径的揭示的特刊,其中包括来自全球七个以上国家的80多名科学家的七篇评论文章和六篇原始研究论文。两个审查手稿提供了丝氨酸/苏氨酸蛋白激酶PKD和PKCθ的概述。Zhang等。 [1]讨论在二酰基甘油第二信号信号网络中运行的蛋白激酶D 1、2和3(PKD)家族成员,影响了不同生物系统和疾病模型中多种基本细胞功能。 Nicolle等。Zhang等。[1]讨论在二酰基甘油第二信号信号网络中运行的蛋白激酶D 1、2和3(PKD)家族成员,影响了不同生物系统和疾病模型中多种基本细胞功能。Nicolle等。在许多人类疾病中发现了PKD同工型表达和活性的失调。本综述着重于与癌症相关的生物学过程(细胞增殖,生存,凋亡,粘附,EMT,迁移和入侵),对此,理解对于开发更安全,更有效的PKD靶向疗法至关重要。蛋白激酶C theta(PKCθ)属于一种新型的PKC亚家族,在免疫系统和各种疾病的病理中起作用。[2]将其审查集中在其在癌症中的新兴功能上。其表达增加会导致细胞增殖,迁移和侵袭,从而导致癌症的启动和恶性进展。在自身免疫性疾病的背景下,PKCθ抑制剂的最新发展可能会使PKCθ与PKCθ有关的癌症的出现有益。pKC被质膜中的脂质激活,并与聚集在表皮生长因子受体(EGFR)上的支架结合。Heckman等人在论文中使用不同的表位识别抗体。[3]证明了PKCε是在两个构象中发现的,其中活性形式定位在内体中,将囊泡运送到内吞回收室中,而灭活则抵消了此功能。另一种形式是可溶的,存在于富含肌动蛋白的结构上,并与囊泡松散结合。因此,活化的PKC持续使用EGFR,更有可能进入内吞回收室。pumilus(Binase)的细菌RNase对具有某些癌基因的肿瘤细胞具有细胞毒性作用。核糖核酸(RNase)的动物,真菌和细菌起源已被证明是开发新型抗癌药物的有前途的工具。在实验贡献中,Ulyanova等人。[4]旨在识别结构
长链非编码 RNA HOTAIR 诱导 PI3K/AKT/...
摘要目的:磷酸肌醇3-激酶/蛋白激酶AKT/哺乳动物雷帕霉素靶蛋白信号通路对细胞正常代谢和细胞生长至关重要。然而,该通路的异常激活与乳腺癌的进展和转移有关。最近,长链非编码RNA在干扰参与细胞生长和代谢的细胞信号通路中的作用已被发现。HOX反义基因间RNA是一种长链非编码RNA,其异常表达与乳腺癌的发展、治疗耐药和转移有关。本研究旨在调查长链非编码RNA HOX反义基因间RNA是否与乳腺癌细胞中的磷酸肌醇3-激酶/蛋白激酶AKT/哺乳动物雷帕霉素靶蛋白信号通路有关。方法:利用siRNA沉默乳腺癌细胞系MCF-7中的HOX反义基因间RNA。随后,使用实时RT-PCR评估HOX反义基因间RNA、PI3K、AKT和mTOR的基因表达水平。此外,使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物)分析法分析细胞增殖。结果:结果显示,与阴性对照相比,HOX反义基因间RNA敲低可以下调MCF-7细胞中PI3K、AKT和mTOR RNA的表达。此外,HOX反义基因间RNA沉默后乳腺癌细胞的增殖显着降低。结论:本研究可能引入HOX反义基因间RNA作为参与乳腺癌细胞中磷酸肌醇3-激酶/蛋白激酶AKT/哺乳动物雷帕霉素靶蛋白信号通路上调的分子,从而可能促进乳腺癌细胞增殖。关键词:MCF-7细胞。HOTAIR长链非编码RNA。RNA。长链非编码。基因表达。
SGLT2抑制剂的心脏保护和抗癌作用
Akt¼蛋白激酶B; ALP¼碱性磷酸酶; a-sma¼a -smooth肌肉肌动蛋白; AMPK¼腺苷单磷酸 - 活化的蛋白激酶; ANP¼14钠肽; Arn¼血管紧张素受体Neprilysin抑制剂; AST¼天冬氨酸氨基转移酶; ATF-4¼激活转录因子4; BAX¼Bcl-2相关X蛋白; B-MHC¼B-肌球蛋白重链; bohb¼b-羟基丁酸酯; BNP¼B型纳特里尿肽; CAT¼过氧化氢酶; CFR¼冠状动脉储备; CK-MB¼肌酸激酶MB; CRS¼心脏综合征; CTNT¼心脏肌钙蛋白T;潮湿¼损伤相关的分子模式; dox¼阿霉素; ECG¼心电图; ef¼射血分数; EIF-2a¼真核生物起始因子2 a; Er¼内质网; ERK¼1.1.1/1/14; FGF¼FIMBLAST生长因子; FS¼部分缩短; g-csf¼1/1/14 GM-CSF¼1/1/1/14 GRP78¼葡萄糖调节的蛋白78; HTN¼高血压; I.P.¼腹膜内; IL¼白痴; IL¼白痴; IL¼白痴; iNOS¼诱导一氧化氮合酶; LDH¼14乳酸脱氢酶; LV¼左心室; lvedd¼左心室末端直径; lvesd¼左心室末端音直径; LVIDD¼左心内直径在末端末端;末端收缩处的LVIDS¼左心内直径; MDA¼MALONDIALLEDEDEDE; MMP¼基质金属肽酶; MPO¼髓过氧化物酶;雷帕霉素的mtor¼哺乳动物靶标; mybpc3¼结合蛋白C3; MyD88¼髓样差异反应88; NCD¼正常食物饮食; NF-kb¼核因子kappa-b; NLRP3¼NOD样受体蛋白3;无¼一氧化氮; NOX-1¼NADPH氧化酶1; NOX-2¼NADPH氧化酶2; NRF2¼核因子红细胞2 - 相关因子2; NT-Proanp¼n末端Pro - 心房纳地肽; NT-PROBNP¼N末端Pro - B型纳地尿肽; p38¼p38有丝分裂原激活的蛋白激酶; PARP¼聚(二磷酸腺苷 - 核糖)聚合酶; PERK¼蛋白激酶R样性内质网激酶; PGC¼过氧化物酶体增殖物 - 激活的受体共激活剂; PI3K¼磷酸肌醇3-激酶; PPAR¼过氧化物酶体增殖物 - 活化受体; QTC¼校正的QT; SIRT1¼SIRTUIN1; Sirt3¼Sirtuin3; Smad3¼母亲反对脱皮的同源物3; SOD¼超氧化物歧化酶; TGF¼转化生长因子; TLR9¼Toll样受体9; TNF¼肿瘤坏死因子; XO¼黄嘌呤氧化酶;其他缩写如表1所示。
在不同发育阶段的后代小鼠海马中,砷暴露对PI3K/AKT/NF-κB信号通路的影响
本研究的主要目的是探索砷对磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(AKT)/核转录因子-κB(NF-κB)信号途径的影响。砷(Naaso 2)的剂量为0、15、30或60 mg/l的雌性小鼠及其幼犬。通过EMSA评估NF-κB的核转运水平。实时RT-PCR用于测量AKT,NF-κB和PI3K mRNA水平。PI3K,P-AKT,抑制剂Kappa B激酶(IKK),P-NF-κB,蛋白激酶A(PKA),抑制剂KAPPA B(IκB)和cAMP反应元件结合蛋白(CREB)的蛋白质表达。结果表明,暴露于60 mg/l NaASO 2可以抑制NF-κB产后日(PND)20和PND 40小鼠的NF-κB水平。砷在PI3K,AKT和NF-κB的转录和翻译水平下调。此外,P-IKK,P-IκB,PKA和P-CREB的蛋白质表达也降低了。总的来说,本研究的结果表明,砷可以下调PI3K/AKT/NF-κB信号传导途径,尤其是在PND 40上,这可能与认知障碍有关。
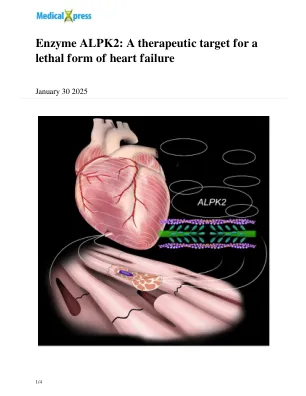
酶 ALPK2:致命心力衰竭的治疗靶点
蛋白质磷酸化过程是调节身体各种功能的关键,包括心脏泵血能力。该过程由一种称为蛋白激酶的酶控制,这种酶将磷酸基团添加到目标蛋白质上的特定氨基酸上。这种修饰会改变蛋白质的结构,导致其活性和与其他分子的相互作用发生变化。酶活性的破坏是心脏僵硬的关键原因。
肥胖和卡路里限制对癌症发展的影响
摘要:世界上恶性肿瘤发展的风险正在增加。肥胖是各种恶性肿瘤的既定风险因素。与肥胖有关的代谢改变有许多促进癌发生的代谢改变。体重过大会导致雌激素,慢性炎症和缺氧的水平增加,这在恶性肿瘤的发展中起着重要作用。证明卡路里限制可以改善各种疾病患者的状态。降低了卡路里摄取的影响脂质,碳水化合物和蛋白质代谢,激素水平和细胞过程。许多研究已致力于卡路里限制对体外和体内癌症发展的影响。揭示了禁食可以调节信号级联反应的活性,包括AMP激活的蛋白激酶(AMPK),有丝分裂原激活的蛋白激酶(MAPK),p53,MTOR,胰岛素/胰岛素样生长因子1(IGF1)和JAK-STAT。途径的上调或下调导致癌细胞增殖,迁移和存活以及化学疗法的凋亡和影响的增加。本综述的目的是讨论肥胖与癌症发展之间的联系以及卡路里限制的机制对癌发生的影响,这强调了对卡路里限制效应进一步研究对将这种方法纳入临床实践的重要性。