XiaoMi-AI文件搜索系统
World File Search System药物成瘾的分子神经生物学
偶联因子(称为 G 蛋白)、第二信使 [例如 cAMP、cGMP、Ca 2 +、一氧化氮 (NO) 和磷脂酰肌醇 (PI) 和花生四烯酸 (AA) 的代谢物] 和蛋白质磷酸化(包括蛋白激酶对磷蛋白的磷酸化和蛋白磷酸酶对磷蛋白的去磷酸化),介导神经递质对其靶神经元的多种作用。第二信使依赖性蛋白激酶(例如由 cAMP 或 Ca 2 + 激活的蛋白激酶)被归类为蛋白丝氨酸/苏氨酸激酶,因为它们在丝氨酸或苏氨酸残基上磷酸化底物蛋白。每个第二信使依赖性蛋白激酶磷酸化都引用一组特定的底物蛋白(可视为第三信使),从而导致神经递质的多种生物反应。对神经递质的多种生物反应可分为三大类。在某些情况下,细胞内信使介导某些神经递质在打开或抑制特定离子通道方面的作用。然而,细胞内信使介导神经递质对其目标神经元的许多其他作用。有些相对短暂,涉及调节神经元的一般代谢状态、合成或释放神经递质的能力以及各种受体和离子通道对各种突触输入的功能敏感性。其他相对长寿,通过调节目标神经元中的基因表达来实现。因此,神经递质通过调节细胞内信使通路和改变基因转录和蛋白质合成,改变了靶神经元中受体和离子通道的数量和类型、这些神经元中细胞内信使系统的功能活动,甚至改变了神经元形成的突触的形状和数量。该图是为了说明细胞内信使系统可以放大神经递质的作用:神经递质与其受体(第一信使水平)结合的单一事件可以通过第二、第三、第四等信使水平起作用,从而产生越来越广泛的生理效应。改编自 Hyman 和 Nestler 1993。
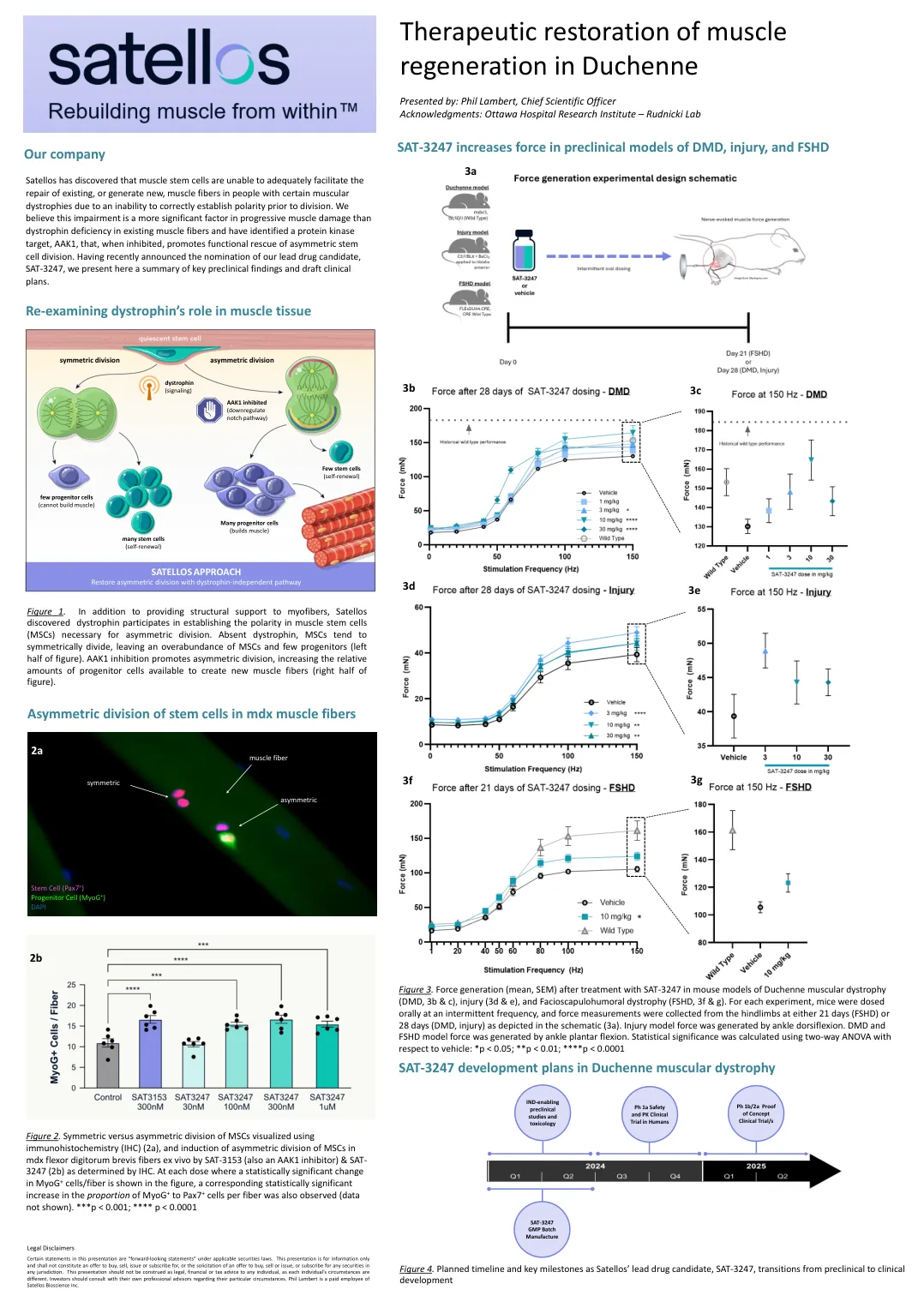
Duchenne中肌肉再生的治疗恢复
卫星发现,由于无法在分裂之前无法正确建立极性,因此肌肉干细胞无法充分促进现有或产生新的肌肉纤维的新肌肉纤维。我们认为,这种损伤比现有肌肉纤维中的肌营养不良蛋白缺乏症更重要,并且已经鉴定出蛋白激酶靶标AAK1,该蛋白激酶靶标在抑制时会促进对非对称干细胞分裂的功能拯救。最近宣布提名我们的主要药物候选人SAT-3247,我们在这里介绍了关键的临床前发现和临床计划草案的摘要。
蛋白激酶抑制剂色瑞替尼阻断外核苷酸酶 CD39——癌症免疫治疗的一个有希望的靶点
摘要 背景 癌细胞实现免疫逃逸的一个重要机制是将细胞外腺苷释放到其微环境中。腺苷激活免疫细胞上的腺苷 A 2A 和 A 2B 受体,这是最强的免疫抑制介质之一。此外,细胞外腺苷促进血管生成、肿瘤细胞增殖和转移。癌细胞上调外核苷酸酶,最重要的是 CD39 和 CD73,它们催化细胞外 ATP 水解为 AMP(CD39)并进一步水解为腺苷(CD73)。因此,抑制 CD39 有望成为癌症(免疫)治疗的有效策略。然而,目前还没有适合 CD39 的小分子抑制剂。我们的目标是识别类药物 CD39 抑制剂并对其进行体外评估。方法我们通过筛选一组自行编制的、已获批准的、大多是 ATP 竞争性的人类 CD39 蛋白激酶抑制剂,采取了一种再利用方法。在各种正交试验和酶制剂以及人类免疫细胞和癌细胞中,进一步表征和评估了最佳命中化合物。结果酪氨酸激酶抑制剂色瑞替尼是一种用于治疗间变性淋巴瘤激酶 (ALK) 阳性转移性非小细胞肺癌的强效抗癌药物,被发现能强烈抑制 CD39,并表现出相对于其他外核苷酸酶的选择性。该药物表现出一种非竞争性、变构的 CD39 抑制机制,在低微摩尔范围内表现出效力,这与底物 (ATP) 浓度无关。我们可以证明色瑞替尼以剂量依赖性方式抑制外周血单核细胞中的 ATP 去磷酸化,导致 ATP 浓度显著增加并阻止 ATP 形成腺苷。重要的是,色瑞替尼 (1-10 µM) 显著抑制了 CD39 天然表达高的三阴性乳腺癌和黑色素瘤细胞中的 ATP 水解。结论 CD39 抑制可能有助于强效抗癌药物色瑞替尼发挥作用。色瑞替尼是一种新型 CD39 抑制剂,具有高代谢稳定性和优化的物理化学性质;据我们所知,它是第一个可穿透脑的 CD39 抑制剂。我们的发现将为 (i) 开发更有效、更平衡的双重 CD39/ALK 抑制剂和 (ii) 优化色瑞替尼支架与 CD39 的相互作用奠定基础,以获得强效且选择性的类药物 CD39 抑制剂,以供未来的体内研究。
引用本文:Jayaraman PS,Gaston K。以蛋白激酶 CK2 为靶点治疗胆管癌。探索靶向抗肿瘤治疗。2021;2:4
胆管癌 (CCA) 是一种预后极差且治疗选择有限的疾病。尽管针对 CCA 中发现的特定突变的靶向疗法正在出现并显示出巨大的潜力,但许多肿瘤并不携带可操作的突变,而对于携带突变的肿瘤,耐药性的出现可能是治疗的结果。针对在 CCA 细胞中活性升高但未因突变而改变的酶和其他蛋白质进行治疗是治疗靶向阴性和耐药性疾病的潜在策略。蛋白激酶 CK2 (CK2) 是一种普遍表达的激酶,在包括 CCA 在内的多种癌症类型中表达增加且活性增加。几种强效 CK2 抑制剂正处于临床前开发阶段或在各种临床试验中进行评估,通常与诱导 DNA 损伤的药物联合使用。本综述概述了 CK2 在 CCA 中的重要性,并评估了在评估 CK2 抑制作为该疾病治疗策略方面取得的进展。根据该蛋白质的表达水平或活性来靶向 CK2 和/或与诱导 DNA 损伤或抑制细胞周期进程的药物联合使用,可能成为缺乏可操作突变的肿瘤或对靶向治疗产生耐药性的肿瘤的可行选择。
Latihan Aerobik Pada糖尿病tipe 2
2型糖尿病(DM 2型)或非胰岛素依赖性糖尿病(NIDDM)已知是与肾脏疾病和死亡中心血管疼痛有关的全球问题。糖尿病控制管理是药物和改变生活方式,以防止糖尿病并发症。有氧运动和一种在预防和治疗糖尿病方面的管理。体育锻炼或运动增加了葡萄糖的肌肉,使肝葡萄糖产生平衡的肌肉。胰岛素和运动通过不同的信号机制刺激葡萄糖转运蛋白4(GLUT4)的易位。胰岛素信号通过胰岛素受体,底物胰岛素受体1(IRS-1)和3-激酶磷脂酰乙二醇激活的快速磷光化机制。由肌肉收缩增加引起的有氧运动刺激了5'AMP激活的蛋白激酶(AMPK)的表达,有丝分裂原激活的蛋白激酶(MAPK)和内质网和CA2+ CA2+钙调蛋白依赖蛋白依赖性蛋白激酶II(CamkKII)的钙。AMPK激活是促进葡萄糖吸收肌肉的主要机制之一。耐药性训练和有氧运动都可以激活AMPK,从而导致GLUT4易位到细胞膜并增加脂肪酸的氧化。关键字:类型2糖尿病,体育锻炼,锻炼
对患有TSC1,TSC2,NF1,NF2或STK11突变的晚期固体恶性肿瘤患者的Everolimus的II期研究
雷帕霉素(MTOR)哺乳动物靶标是一种关键蛋白激酶,可调节细胞生长,增殖和存活率(1)。 MTOR途径的激活与几种恶性肿瘤的发展有关(2,3)。 该蛋白激酶主要通过AKT和结节性硬化症复合物(TSC1/TSC2)通过PI3K途径激活(1)。 该途径也受肿瘤抑制剂(例如STK11和NF1)的调节,这些途径经常在不同的癌症中改变(4,5)。 stk11,也称为LKB1,通过激活AMPK和TSC2的磷酸化激活MTOR,而NF1通过终止Ras蛋白的活性状态(4,5)来阻止MTOR途径的下游激活。 TSC1,TSC2,STK11和NF1基因中的突变会导致MTOR途径失调并促进肿瘤细胞的生长(6)。 抑制mTOR可以代表一种治疗固体瘤的方法,该方法在STK11,NF1,TSC1和TSC2等肿瘤抑制子中含有突变。哺乳动物靶标是一种关键蛋白激酶,可调节细胞生长,增殖和存活率(1)。MTOR途径的激活与几种恶性肿瘤的发展有关(2,3)。该蛋白激酶主要通过AKT和结节性硬化症复合物(TSC1/TSC2)通过PI3K途径激活(1)。该途径也受肿瘤抑制剂(例如STK11和NF1)的调节,这些途径经常在不同的癌症中改变(4,5)。stk11,也称为LKB1,通过激活AMPK和TSC2的磷酸化激活MTOR,而NF1通过终止Ras蛋白的活性状态(4,5)来阻止MTOR途径的下游激活。TSC1,TSC2,STK11和NF1基因中的突变会导致MTOR途径失调并促进肿瘤细胞的生长(6)。抑制mTOR可以代表一种治疗固体瘤的方法,该方法在STK11,NF1,TSC1和TSC2等肿瘤抑制子中含有突变。
2023韩国糖尿病协会的糖尿病临床实践指南糖尿病通过AMPK/EZH2/...
背景:糖尿病引起的心脏纤维化是糖尿病心肌病的主要机制之一。作为一种常见的His-甲基甲基转移酶,Zeste同源2(EZH2)的增强子与多个器官的纤维化进展有关。但是,尚未阐明EZH2在糖尿病心肌纤维化中的机制。方法:在当前的研究中,建立了大鼠和小鼠糖尿病模型,通过超声心动图评估了大鼠和小鼠的左心室功能,并通过Masson染色评估了大鼠心室的纤维化。原发性大鼠心室纤维爆炸在体外培养并用高葡萄糖(Hg)刺激。分析了组蛋白H3赖氨酸27(H3K27)三甲基 - EZH2和心肌纤维化蛋白的表达。结果:在STZ诱导的糖尿病性心室组织和HG诱导的原发性心室成纤维细胞体外,H3K27三甲基蛋白增加增加,EZH2的磷酸化降低。用GSK126抑制EZH2,抑制了心脏成纤维细胞的激活,分化和迁移,以及Hg诱导的纤维化蛋白的过表达。 机械研究表明,HG通过失活AMP激活的蛋白激酶(AMPK)在THR311上的磷酸化降低,该蛋白激酶(AMPK)在转录上抑制过氧化物酶体增殖物激活的受体γ(PPAR-γ)的表达以促进Fi-Brablasts激活和分化。 结论:我们的数据显示AMPK/EZH2/PPAR-γ信号途径与HG诱导的心脏纤维化有关。用GSK126抑制EZH2,抑制了心脏成纤维细胞的激活,分化和迁移,以及Hg诱导的纤维化蛋白的过表达。机械研究表明,HG通过失活AMP激活的蛋白激酶(AMPK)在THR311上的磷酸化降低,该蛋白激酶(AMPK)在转录上抑制过氧化物酶体增殖物激活的受体γ(PPAR-γ)的表达以促进Fi-Brablasts激活和分化。结论:我们的数据显示AMPK/EZH2/PPAR-γ信号途径与HG诱导的心脏纤维化有关。
探索目前使用的激酶抑制剂的化疗潜力:最新进展
蛋白激酶是一种将磷酸盐转移到蛋白质上的酶,可导致蛋白质发生修饰。人类基因组编码了大约 538 种激酶。激酶在维持许多细胞过程方面发挥着作用,包括控制细胞周期、代谢、存活和分化。蛋白激酶失调会导致多种疾病,并且已证明许多激酶在癌症中失调。这些激酶的致癌潜力因多种过程而增加,包括过度表达、重新定位、融合点突变和上游信号传导中断。对激酶机制或作用的了解已导致大量具有良好临床益处的激酶抑制剂的开发。在这篇综述中,我们讨论了 FDA 批准的激酶抑制剂及其机制、临床益处和副作用,以及克服某些副作用的挑战和新激酶抑制剂发现的未来前景。
DCC-3084 是一种 RAF 二聚体抑制剂,可广泛抑制 BRAF I、II、III 类、BRAF 融合和 RAS 驱动的实体瘤,从而导致
ARAF,丝氨酸/苏氨酸蛋白激酶 A–快速加速纤维肉瘤;ATP,三磷酸腺苷;AUC,浓度时间曲线下面积;AUC 0–last,从时间 0 到最后测量浓度的 AUC;BCRP,乳腺癌耐药蛋白转运蛋白;BID,每日两次;BRAF,v-Raf 鼠肉瘤病毒致癌基因同源物 B1;CNS,中枢神经系统;CRAF,丝氨酸/苏氨酸蛋白激酶 C-Raf;CSF,脑脊液;DFG,天冬氨酸-苯丙氨酸-甘氨酸;DMSO,二甲基亚砜;ELISA,酶联免疫吸附试验;ERK,细胞外信号调节激酶;GTP,三磷酸鸟苷;hrs,小时;IC 50,半数最大抑制浓度; Kp uu,非结合分配系数(游离脑浓度/游离血浆浓度);KRAS,Kirsten RAS;M,摩尔;MDR1,多药耐药突变转运体;MEK,丝裂原活化蛋白激酶激酶;NRAS,神经母细胞瘤 RAS;PERK,蛋白激酶 R 样内质网激酶;PK,药代动力学;po,口服;pRSK,磷酸化 RSK;QD,每日一次;RAF,快速加速性纤维肉瘤;RAS,大鼠肉瘤小 GTPase 蛋白;RSK,核糖体 s6 激酶;SEM,均值标准误差;t 1/2,半衰期;TGI,肿瘤生长抑制;T. sol,热力学溶解度;WT,野生型。