XiaoMi-AI文件搜索系统
World File Search SystemDCC-3084 是一种 RAF 二聚体抑制剂,可广泛抑制 BRAF I、II、III 类、BRAF 融合和 RAS 驱动的实体瘤,从而导致
ARAF,丝氨酸/苏氨酸蛋白激酶 A–快速加速纤维肉瘤;ATP,三磷酸腺苷;AUC,浓度时间曲线下面积;AUC 0–last,从时间 0 到最后测量浓度的 AUC;BCRP,乳腺癌耐药蛋白转运蛋白;BID,每日两次;BRAF,v-Raf 鼠肉瘤病毒致癌基因同源物 B1;CNS,中枢神经系统;CRAF,丝氨酸/苏氨酸蛋白激酶 C-Raf;CSF,脑脊液;DFG,天冬氨酸-苯丙氨酸-甘氨酸;DMSO,二甲基亚砜;ELISA,酶联免疫吸附试验;ERK,细胞外信号调节激酶;GTP,三磷酸鸟苷;hrs,小时;IC 50,半数最大抑制浓度; Kp uu,非结合分配系数(游离脑浓度/游离血浆浓度);KRAS,Kirsten RAS;M,摩尔;MDR1,多药耐药突变转运体;MEK,丝裂原活化蛋白激酶激酶;NRAS,神经母细胞瘤 RAS;PERK,蛋白激酶 R 样内质网激酶;PK,药代动力学;po,口服;pRSK,磷酸化 RSK;QD,每日一次;RAF,快速加速性纤维肉瘤;RAS,大鼠肉瘤小 GTPase 蛋白;RSK,核糖体 s6 激酶;SEM,均值标准误差;t 1/2,半衰期;TGI,肿瘤生长抑制;T. sol,热力学溶解度;WT,野生型。
致编辑的信:针对 CGAS-STING 信号
亨廷顿舞蹈症 (HD) 是一种严重的成人遗传性神经系统疾病,具有多种临床表现,包括抑郁、认知能力下降和舞蹈症(以前称为亨廷顿舞蹈症),始于 40 岁左右,到 65 岁时严重程度可能会加剧。据估计,全球每 100,000 人中就有 13-14 人患有这种疾病。亨廷顿舞蹈症主要影响大脑的区域是尾状核和壳核,它们是纹状体的组成部分。由于皮质锥体神经元和中棘神经元参与运动过程,因此在亨廷顿舞蹈症中更容易发生退化。亨廷顿舞蹈症的主要病因是亨廷顿基因 (Htt) 的突变,其特征是 Htt 外显子 1 中的 CAG(胞嘧啶、腺嘌呤、鸟嘌呤)三联体重复增加(Kumar 等人,2021 年)。由于该疾病的复杂性质,尚未找到长期解决方案;目前,治疗 HD 症状的唯一选择包括可逆性囊泡单胺转运体 2 型 (VMAT-2) 抑制剂丁苯那嗪和氘代丁苯那嗪,这两种药物已获得美国 FDA 批准 (Claassen 等人,2022 年)。
使用大肠杆菌作为宿主进行重组胰岛素生产的挑战
在马来西亚,糖尿病 (DM) 的患病率取决于性别、年龄和种族等因素,其中女性、老年人和印度族群的糖尿病患病率最高。在构成研究样本的 103,063 名参与者中,基于人群的研究中按性别划分的糖尿病患病率男性为 13.80%,女性为 14.54%,而糖尿病前期的患病率女性为 11.40%,男性为 10.98%(Akhtar 等人,2022 年)。就年龄而言,从本研究可以看出,随着年龄的增长,糖尿病的患病率呈明显上升趋势,从 20-29 岁年龄组的 3.16% 上升到 30-45 岁年龄组的 13.71%,46-59 岁年龄组的 25.66%,60 岁及以上年龄组的 33.45% (Akhtar et al., 2022)。种族和民族也会影响糖尿病的患病率。在所有种族中,印度人亚群的糖尿病患病率最高,为 25.10%,其次是马来人(15.25%)、华人(12.87%)、土著人(8.62%)和其他(6.91%)。马来西亚口服降糖药 (OHA) 市场规模在 2025 年达到 2.8222 亿美元,预测期内 (2025-2030) 的复合年增长率超过 3%。药物主要属于以下类别:双胍类、α-葡萄糖苷酶抑制剂、多巴胺-d2 受体激动剂、钠-葡萄糖协同转运体-2 (SGLT-2) 抑制剂、二肽基肽酶-4 (DPP-4) 抑制剂、磺酰脲类和格列奈类 (马来西亚口服抗糖尿病药物市场规模 | Mordor Intelligence,2025 年)。
重新利用的药物作为临床治疗的 MCU 通道调节剂的出现
线粒体 Ca 2 + 吸收由高度选择性通道线粒体钙单向转运体 (MCU) [1-4] 介导,并响应各种生理刺激而发生,这些刺激通常由内质网释放 Ca 2 + 触发。MCU 复合物的核心成分包括成孔亚基(即 MCU 和必需 MCU 调节器 [EMRE])和调节蛋白(即 MCUb、MCUR1、MICU1、MICU2、MICU3、LETM1 和 SLC25A23)。多项研究已阐明了 MCU 单独和与 EMRE 结合的结构 [4],揭示了与 EMRE 具有 1:1 化学计量的四聚体结构。MCU 复合物成分的遗传变异与多种疾病的发展有关,表明该通道在生物体生理学中发挥重要作用。例如,MCU 过表达与肺癌、胃癌和肝癌的进展有关。此外,MCU 正向调节肌纤维大小,而骨骼肌特异性 MCU 缺失会抑制肌纤维线粒体 Ca 2 + 摄取,导致肌肉力量和运动表现受损。据报道,近端肌病、学习困难和锥体外系运动障碍患者存在调节成分 MICU1 的突变 [5]。此外,MICU1 在 db/db 小鼠心脏中下调,这导致糖尿病患者心肌细胞凋亡。MICU2 的纯合截短突变会导致严重的神经发育障碍,影响近亲患者。此外,MICU2 的沉默最近与胰腺 β 细胞功能受损有关。总之,这些发现令人信服地描绘了 MCU 复合物在维持正常细胞功能方面的生理重要性。考虑到线粒体 Ca 2 +
固体脂质纳米粒子 (SLN) 作为一种新型药物输送...
文章历史:提交日期:2020 年 3 月 6 日修订日期:2020 年 4 月 10 日接受日期:2020 年 5 月 11 日摘要固体脂质纳米粒子 (SLN) 于 1991 年底首次推出,作为已知的旧胶体载体(如乳液、脂质体和聚合物微粒和纳米粒子)的替代转运系统。SLN 具有经典结构的优点和潜力,但避免了它们的一些常见和已知的缺点。本文回顾了 SLN 的生产技术、药物的整合、负载能力和药物的释放,特别强调了药物释放技术。与将 SLN 引入制药行业有关的问题,例如赋形剂的地位。从一开始,在过去十年中,脂质纳米粒子 (LNP) 就引起了特别广泛的关注。纳米结构脂质转运体强脂质纳米颗粒 (SLN) 成为由脂质形成的两种最重要的纳米颗粒形式。SLN 的设计能够克服某些类型的胶体载体的限制,如脂质体、乳液和聚合物纳米颗粒,因为它们具有良好的一面,如强大的排放曲线和引导药物分布,具有最完美的物理健康。NLC 将在下一代脂质纳米颗粒中改进 SLN,以增强稳定性、安全性和容量负载。本文重点介绍使用均质化和溶剂蒸发等先进生产技术减少毒性作用的方法。因为它为固体脂质纳米颗粒提供了便利
乳腺癌仍然是全球面临的重大健康挑战,其耐药性和紫杉醇 (PTX) 等化疗药物的生物利用度低对有效治疗构成了障碍。本研究使用计算方法研究了溶质载体有机阴离子转运体多肽 1A2 (OATP1A2) 在 PTX 转运中的潜在作用。我们采用计算建模、分子对接和分子动力学 (MD) 模拟来阐明 OATP1A2 的结构动力学及其与 PTX 的相互作用。使用 Phyre2 对 OATP1A2 结构进行建模、验证和改进。分子对接表明在预测的结合位点内存在显著的 PTX 相互作用,结合亲和力为 -10.4 kcal/mol,初始与 Arg 656 和 Gly 560 形成氢键,与 Glu 66 、 Phe 65 、Asn 41 、Ala 203 、Ile 204 、Phe 329 、Phe 332 、Ile 336 、Pro 207 、Ser 337 、Asn 334 发生疏水相互作用。与我们最初关于药物向内运动的假设相反,500 纳秒的 MD 模拟表明 PTX 意外地向外运动。配体从其初始结合位置向细胞外侧移动了约 5.4 Å。这一观察结果表明运输机制比最初预期的更为复杂。蛋白质-配体复合物在整个模拟过程中表现出稳定性,并具有显着的构象变化。我们的研究结果强调了 OATP1A2 介导的运输的复杂性及其对 PTX 输送的潜在限制。这些结果强调了转运蛋白介导的药物输送的复杂性,并可能为提高乳腺癌治疗化疗效果的未来策略提供参考。
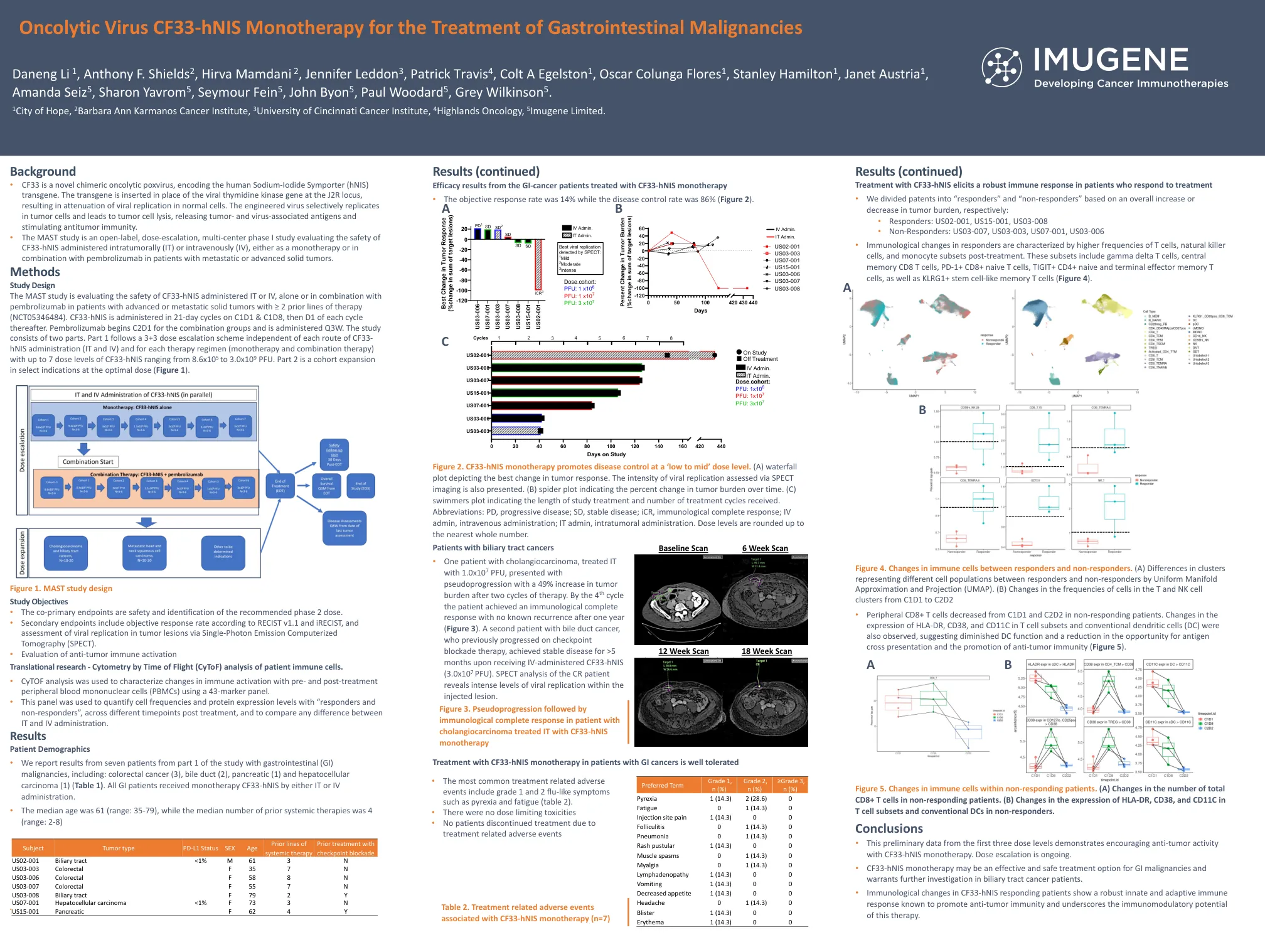
溶瘤病毒CF33-hNIS单一疗法治疗胃肠道恶性肿瘤
背景 • CF33 是一种新型嵌合溶瘤痘病毒,编码人类钠碘转运体 (hNIS) 转基因。转基因插入 J2R 基因座的病毒胸苷激酶基因位置,导致正常细胞中病毒复制减弱。工程病毒选择性地在肿瘤细胞中复制并导致肿瘤细胞裂解,释放肿瘤和病毒相关抗原并刺激抗肿瘤免疫。 • MAST 研究是一项开放标签、剂量递增、多中心 I 期研究,评估 CF33-hNIS 肿瘤内 (IT) 或静脉内 (IV) 给药的安全性,无论是作为单一疗法还是与派姆单抗联合用于转移性或晚期实体瘤患者。方法研究设计 MAST 研究正在评估 CF33-hNIS 单独或与帕博利珠单抗联合通过 IT 或 IV 给药的安全性,适用于既往接受过 ≥ 2 种治疗方案的晚期或转移性实体瘤患者(NCT05346484)。CF33-hNIS 在 C1D1 和 C1D8 以 21 天为一个周期给药,之后每个周期的 D1 给药。联合组的帕博利珠单抗从 C2D1 开始,每三周给药一次。该研究分为两部分。第 1 部分遵循 3+3 剂量递增方案,与每种 CF33- hNIS 给药途径(IT 和 IV)和每种治疗方案(单一疗法和联合疗法)无关,CF33-hNIS 剂量水平最多可达 7 个,范围从 8.6x10 5 至 3.0x10 9 PFU
病毒追踪证实了旁黑质腹侧被盖区多巴胺能输入至脚间核,在此多巴胺释放编码动机性探索
中脑腹侧被盖区 (VTA) 的多巴胺能 (DAergic) 神经元受奖励刺激的刺激,并编码奖励预测误差以更新目标导向学习。然而,最近的数据表明,VTA DAergic 神经元在功能上是异质性的,在厌恶信号、显着性和新颖性方面发挥着新的作用,部分基于解剖位置和投射,突出了在动机行为中对 VTA DAergic 传出神经元库进行功能表征的必要性。先前的研究确定了一个由 VTA DAergic 神经元组成的中脑脚间回路,该回路投射到脚间核 (IPN),一个与厌恶、焦虑样行为和熟悉感有关的中脑区域,但最近受到了质疑。为了验证该回路的存在,我们在多巴胺转运体-Cre 小鼠系中结合了突触前靶向和逆行病毒示踪。与以前的报告一致,突触示踪显示来自 VTA 的轴突终末支配尾部 IPN;而逆行示踪显示 DAergic VTA 神经元(主要位于旁黑质区域)投射到伏隔核壳以及 IPN。为了测试 IPN 中是否存在功能性 DAergic 神经传递,我们在 C57BL/6J 小鼠的 IPN 中表达了遗传编码的 DA 传感器 dLight 1.2,并使用光纤光度法在社交和焦虑样行为期间体内测量了 IPN DA 信号。我们观察到在对新但不熟悉的同类进行社交调查期间以及在探索高架十字迷宫的焦虑开放臂期间 IPN DA 信号增加。总之,这些数据证实了 VTA DAergic 神经元向 IPN 的投射,并暗示该回路参与了动机探索的编码。
为期两天的“工程师生物学”FDP
什么是生物分子?生物分子,也称为生物分子,是细胞和生物体产生的众多物质之一。生物分子具有多种尺寸和结构,并具有多种功能。四种主要类型的生物分子是碳水化合物、脂质、核酸和蛋白质。在生物分子中,核酸(即 DNA 和 RNA)具有存储生物体遗传密码的独特功能 - 决定蛋白质氨基酸序列的核苷酸序列,这对地球上的生命至关重要。蛋白质中可以出现 20 种不同的氨基酸;它们出现的顺序在确定蛋白质结构和功能方面起着根本性的作用。蛋白质本身是细胞的主要结构元素。它们还充当转运体,将营养物质和其他分子移入和移出细胞,并作为酶和催化剂参与生物体内发生的绝大多数化学反应。蛋白质还形成抗体和激素,并影响基因活动。碳水化合物主要由含碳、氢和氧原子的分子组成,是所有生命的基本能量来源和结构成分,也是地球上最丰富的生物分子之一。它们由四种糖单元组成——单糖、双糖、寡糖和多糖。脂质是生物体的另一种关键生物分子,具有多种作用,包括作为储存能量的来源和化学信使。它们还形成膜,将细胞与周围环境隔开,并将细胞内部分隔开来,在高等(更复杂)生物中产生细胞器,如细胞核和线粒体。例子包括胞苷、尿苷、腺苷、鸟苷和胸苷。核苷经磷酸化后变成核苷酸。除了作为核酸的结构单元外,核苷酸还可以作为化学能的来源(例如三磷酸腺苷或 ATP)。
甘草查尔酮 E 是一种淀粉样蛋白聚集抑制剂,通过抑制 CTL1 介导的胆碱吸收来调节小胶质细胞 M1/M2 极化
摘要:阿尔茨海默病 (AD) 被认为是一系列神经炎症疾病,其病因之一是脑内淀粉样蛋白-β (A β ) 和 tau 蛋白的异常沉积。我们重点研究了小胶质细胞中的 A β 聚集和 M1 和 M2 小胶质细胞极性,以寻找新型治疗药物。据报道,小胶质细胞中胆碱转运体样蛋白 1 (CTL1) 的胆碱摄取抑制优先诱导 M2 小胶质细胞极性。然而,胆碱转运系统在调节 AD 小胶质细胞 M1/M2 极性方面的作用尚不完全清楚。据报道,从甘草中提取的黄酮类化合物甘草查尔酮 (Licos) A–E 具有免疫抗炎作用,而 Lico A 可抑制 A β 聚集。在本研究中,我们比较了从 Lico A 到 Lico E 的五种 Licos 抑制 A β 1-42 聚集的效果。在五种 Licos 中,我们选择了 Lico E,使用永生化小鼠小胶质细胞系 SIM-A9 研究胆碱摄取抑制与小胶质细胞 M1/M2 极化之间的关系。我们新发现 Lico E 以浓度依赖性方式抑制 SIM-A9 细胞中的胆碱摄取和 A β 1-42 聚集,这表明 Lico E 对胆碱摄取的抑制作用是由 CTL1 介导的。A β 1-42 增加了 M1 小胶质细胞标志物肿瘤坏死因子 (TNF- α ) 的 mRNA 表达,并且胆碱剥夺和 Lico E 以浓度依赖性方式抑制了其作用。相反,IL-4 可增加 M2 小胶质细胞标志物精氨酸酶-1 (Arg-1) 的 mRNA 表达,而胆碱剥夺和 Lico E 可增强其作用。我们发现 Lico E 对 A β 聚集有抑制作用,并通过抑制小胶质细胞中的 CTL1 功能促进从 M1 到 M2 小胶质细胞的极性。因此,Lico E 可能成为治疗 AD 的新型领先化合物。