XiaoMi-AI文件搜索系统
World File Search System使用来自孤立环境细菌的新型回试的噬菌体防御和基因组编辑
反发是细菌免疫系统,可通过杀死受感染的宿主来保护细菌种群免受噬菌体的影响。反击通常包含逆转录酶,一个非编码RNA的模板,该模板被部分转录为RT-DNA和毒性效应子。逆转录酶,非编码RNA和RT-DNA复合物隔离了毒性效应子,直到被噬菌体感染触发为止,此时,毒素被释放出来诱导细胞死亡。由于它们在体内产生单链DNA的能力,还设计了回试以在原核生物和真核生物中生产用于基因组编辑的供体模板。然而,当前的实验表征反元的曲目受到限制,大多数回试来自细菌的临床和实验室菌株。为了更好地了解反逆转录生物学和自然多样性,并扩大了基于反逆转录基因组编辑器的当前工具箱,我们开发了一条管道来分离反替补箱及其细菌宿主与各种环境样品的分离。在这里,我们介绍了这些新颖的反词中的六个,每一个都从不同的宿主细菌中分离出来。我们表征了这些重试的完整操纵子,并测试了它们防御大肠杆菌噬菌体小组的能力。对于其中两个重演,我们通过识别负责触发流产感染的噬菌体基因来进一步揭示其防御机理。最后,我们在大肠杆菌中对这些基因组编辑进行了设计,证明了它们在生物技术应用中的潜在用途。
病理生物学(PATH)
PATH 2200。现代生物医学实验室技术。(3 学分)综合项目式实验室课程,利用各种现代生物医学技术识别未知病原体并表达抗原以开发疫苗和诊断检测。涵盖的主题包括下一代测序、CRISPR 基因编辑、mRNA 技术、基因克隆和表达、蛋白质纯化和分析、免疫测定和逆转录定量 PCR 开发。入学要求:BIOL 1107 或同等课程。建议准备:PATH 1202。查看课程(https://catalog.uconn.edu/course-search/?details&code=PATH%202200)
理学学士微生物学第三学期和第四学期...
第一单元 遗传工程简介。DNA、RNA 和蛋白质分析方法:琼脂糖凝胶电泳、Southern 和 Northern 印迹技术、点印迹、SDS-PAGE 和 Western 印迹。DNA 修饰酶及其应用:限制酶、DNA 聚合酶。末端脱氧核苷酸转移酶、激酶和磷酸酶以及 DNA 连接酶。第二单元 聚合酶链式反应。C-DNA 合成和克隆:mRNA 富集、逆转录、接头、衔接子、平端连接、同聚物加尾。基因组和 cDNA 文库:制备和用途、基因组测序。DNA 测序:传统和自动测序。
鉴定新型 SLC8A1-ALK 融合和非...
背景:约 2-7% 的非小细胞肺癌患者发生间变性淋巴瘤激酶 (ALK) 重排事件。值得注意的是,典型的 ALK 可操作重排对酪氨酸激酶抑制剂 (TKI) 治疗敏感。然而,不同类型的 ALK 融合会影响这种治疗方法的临床结果。约 10-40% 的 ALK 融合阳性非小细胞肺癌患者对 ALK-TKI 治疗无反应。因此,准确识别 ALK 重排类型对于选择合适的临床治疗方法非常重要。病例报告:使用 DNA 靶向下一代测序技术,我们在一名肺腺癌患者中发现了一种新的溶质载体家族 8 成员 A1 (SLC8A1)-ALK 融合类型。进一步的逆转录聚合酶链反应和桑格测序证实,在转录水平上,重排为 B 细胞 CLL/淋巴瘤 11A (BCL11A)-ALK 融合。患者对克唑替尼治疗表现出快速而强烈的反应,持续 9 个月。患者在对克唑替尼产生耐药性后,对阿来替尼治疗也反应良好。结论:DNA 靶向下一代测序与 RNA 逆转录聚合酶链反应和测序相结合的策略,加上荧光原位杂交和免疫组织化学,可为正确识别伴侣基因和融合结构提供有效且实用的解决方案,用于诊断 ALK 重排,特别是对于 ALK 融合事件的非规范表达模式。联合方法可能为患者带来更多益处。关键词:肺腺癌、间变性淋巴瘤激酶重排、酪氨酸激酶抑制剂、治疗、病例
Victor Billon、Gael Cristofari。新生 RNA m6A 修饰是基因-逆转录转座子冲突的核心。Cell Research,2021 年,在线发表
长散布元件 1 (L1) 逆转录转座子是一种转座元件,能够通过 RNA 中间体和逆转录步骤的复制粘贴机制在基因组内传播。它们存在于许多真核生物谱系中,但在哺乳动物中一直特别活跃,并且仍然如此,充当着强大的内源诱变剂。它们被细胞核和细胞质中的多层转录和转录后机制强烈抑制,从而限制了它们在生殖细胞、早期胚胎和一组非常狭窄的成人体细胞中的表达和动员。尽管如此,其中一些元件设法挣脱这些锁并插入新的基因组位置,通常落在内含子中,有时会导致遗传疾病 1 。
通过针对大脑的硫磺区域的靶向刺激来诱发高度局灶性感知以进行感觉恢复
为了诊断Covid-19,预计呼吸道或血液样本的核酸扩增试验(NAAT)将使用逆转录实时泛效聚合酶链反应(RT-PCR)产生阳性结果[2]。然而,由于当前的临床经验,由于早期病毒载量低,检测率和灵敏度较低。因此,不可避免地给出错误的结果。此外,它只能给出正面或负面的结果。无法监测感染的严重程度和进展。在从患者那里获得测试样本后确定测试结果可能需要1天或更长时间。在疑似COVID-19的患者中,测试结果为阴性,但是如果在CT成像结果中发现发现,则应尽快对患者进行隔离和治疗[3]。这是
基因表达分析通过定量...
设计RT-QPCR分析时,重要的是决定是使用总RNA还是纯化的mRNA作为逆转录模板。mRNA可能会提供更多的敏感性,但是通常使用总RNA,因为它比mRNA具有重要的优势作为起始材料。首先,需要更少的纯化步骤,这确保了模板的更定量恢复,并且可以更好地将结果标准化为单元格的起始数。第二,通过避免任何mRNA富集步骤,人们避免了由于不同mRNA的回收率不同而导致结果偏斜的可能性。总的来说,在大多数情况下,总RNA更适合使用,因为对大多数应用的相对量化比检测的绝对敏感性更重要。
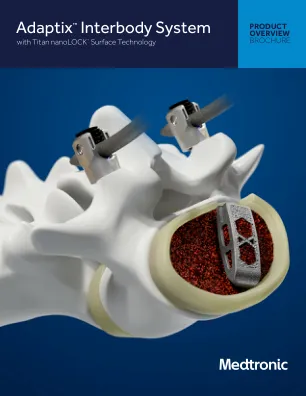
Adaptix™Interbody System
指示带有Titan Nanolock™表面技术的Adaptix™Interbody系统旨在用于脊柱融合手术中,用于诊断出患有退行性椎间盘疾病(DDD)的患者,以一两个连续的水平从L2到S1。DDD患者在涉及水平上也可能具有高达1级脊椎滑脱或逆转录病。ddd被定义为通过病史和射线照相研究证实的椎间盘的变性,将其定义为盘状背痛。带有Titan Nanolock™表面技术的Adaptix™Interbody系统旨在与用于腰椎使用的补充固定系统一起使用。
利用 prime 编辑系统高效生成小鼠模型
亲爱的编辑,人类的大多数遗传疾病是由单核苷酸突变引起的。尽管使用基于 CRISPR 的胞嘧啶碱基编辑器 (CBE) 1 或腺嘌呤碱基编辑器 (ABE) 2 进行基因组编辑对于某些遗传疾病中 C 到 T 和 A 到 G 碱基替换的基因校正大有希望 3,4,但这两种编辑器对于纠正其他变异(如碱基颠换、小插入和缺失 (indel))均无效。prime editing 系统是一种“搜索和替换”基因组编辑技术,最近被添加到基因组编辑工具包 5 中。prime editors (PEs) 结合了外源性 CRISPR/Cas9 系统和内源性 DNA 修复系统,以实现更大的编辑多功能性,诱导 CBE 和 ABE(C → T、G → A、A → G 和 T → C)之外的所有类型的碱基到碱基转换、小插入/缺失及其组合。基因组编辑系统从PE1进化到PE3(PE3b),效率逐步提高5。PE1的执行器由工程化的Cas9切口酶与逆转录酶(M-MLV RTase)5融合构建,可靶向基因组位点,切口DNA并引发逆转录(RT)。执行器结合工程化的基因组编辑向导RNA(pegRNA)寻找并切口目标DNA,从而通过RT将新的遗传信息编码到基因组中。然后,对M-MLV RTase引入突变以提高PE1的编辑效率,此PE2被称为PE2。随后,在PE3b中,执行器与工程化的Cas9切口酶5融合,可靶向基因组位点,切口DNA并引发逆转录(RT)。执行器与工程化的基因组编辑向导RNA(pegRNA)结合,寻找并切口目标DNA,从而通过RT将新的遗传信息编码到基因组中。然后,对M-MLV RTase引入突变以提高PE1的编辑效率,此PE2被称为PE2。