XiaoMi-AI文件搜索系统
World File Search System通过 Prime 编辑纠正致病突变
Camille Bouchard 1,2,*、Kelly Godbout 1,2,*、Jacques P. Tremblay 1,2 > 基因编辑是一个不断发展的领域,其中 Prime 编辑是最新的技术之一。它允许使用仅切割一条 DNA 链的 Cas9 切口酶来修改基因以进行测量。该切口酶与逆转录酶融合,将定制合成的向导 RNA 复制到 DNA 中。该技术用于在细胞或动物模型中创建精确的突变。通过纠正导致致病效应的突变,Prime 编辑还应用于治疗遗传性疾病的临床研究。剩下的挑战是将治疗性分子复合物“递送”至体内细胞。已开发出不同的方法来到达针对每种疾病的特定器官。
PD-1抑制剂联合抗血管生成及表皮生长因子受体酪氨酸激酶治疗MGMT启动子未甲基化的胶质母细胞瘤
根据WHO肿瘤分类实用方法组织(非WHO官方组织)的诊断标准,缺乏GBM组织学特征的IDH野生型弥漫性星形细胞瘤或间变性星形细胞瘤,可能同时具备以下分子遗传学特征之一:EGFR扩增;7号染色体获得/10号染色体缺失;端粒酶逆转录酶(TERT)启动子突变,均应诊断为弥漫性星形细胞胶质瘤,IDH野生型,具备GBM分子病理学特征,WHO IV。随着对GBM生物学特性的认识不断加深,针对特定信号通路和微环境的药物研究也越来越多,如靶向药物、抗血管药物和免疫治疗等,但这些药物单独使用对GBM的改善作用并不明显。
vemlidy®电阻概况
使用HEPG2细胞在短暂转染测定法中,评估了包含与HBV核苷逆转录酶抑制剂耐药性相关的一组分离株的抗病毒活性。HBV分离出表达lamivudine抗性相关取代的RTM204V/I(±RTL180M±RTV173L)并表达与Entecavir抗性相关的取代RTTT184G,RTS202G,RTS202G,或RTM250V在RTM250V中显示RTM250V,RTM250V均和RTL180M和RTL180M。 TAF的敏感性(在测定间变异性内)。HBV分离株表达RTA181T,RTA181V或RTN236T与Adefovir抗性相关的单个替代物在EC 50值中的变化<2倍;然而,表达RTA181V加RTN236T双重取代的HBV分离物表现出对TAF的敏感性(3.7倍)。这些取代的临床相关性尚不清楚。
艾滋病毒耐药性
在乌干达,自 21 世纪初以来,卫生部 (MoH) 逐步推行公共部门抗逆转录病毒治疗 (ART) 计划,通过经认可的医疗机构提供免费 ART。接受 ART 治疗的人数已从 2003 年的 20,000 人增加到 2017 年底的 1,000,000 多人 (3)。2014 年,卫生部采纳了世卫组织/联合国艾滋病规划署 2020 年目标,截至 2017 年底,估计乌干达有 1,324,685 名艾滋病毒感染者 (3)。其中 1,189,811 人 (90%) 知道自己的艾滋病毒状况;在知道自己的艾滋病毒状况的人中,1,140,420 人 (96%) 正在接受治疗,在接受治疗的人中,992,165 人 (87%) 病毒得到抑制 (3)。 2016 年,乌干达对开始或重新开始 ART 治疗的成年人进行了一项 HIVDR 调查,结果显示总体加权 HIVDR 患病率为 18.2% (4),其中非核苷逆转录酶抑制剂 (NNRTI) 患病率最高,为 14.1% (4)。
用反向移动欺骗噬菌体
逆转录酶(RTS),使用RNA模板合成DNA的酶,广泛分布在生命的所有领域中。这些酶在多种过程中具有作用,包括在逆转和移动遗传元素以及端粒生物学的生命周期中。在细菌中,RT对抗爆抗防御特别重要,并且被多种遗传系统使用,其作用是保护细菌免受噬菌体的影响。例如,一些CRISPR-CAS系统使用逆转录对RNA噬菌体(3)的核酸(“间隔者”)的新免疫盒(“垫片”)。rts也用于称为回试的反出发遗传系统中,该遗传系统由三个编码RT,NCRNA和“效应子”毒素的基因组成。通过反向转化的过程,反式反应产生嵌合核酸链,其中DNA和RNA共价链接。该嵌合DNA-RNA分子的作用尚不清楚,但已显示为
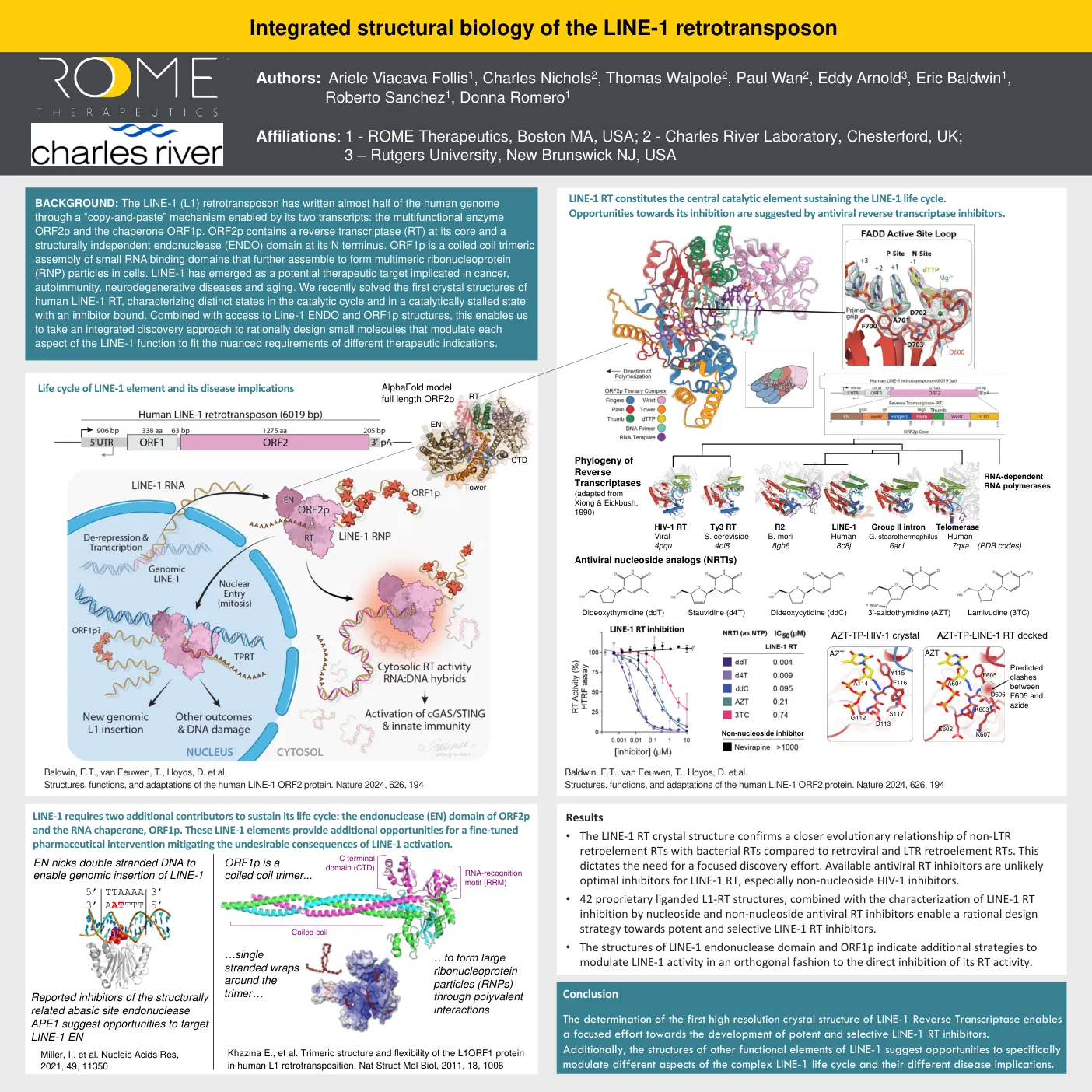
LINE-1 逆转录转座子的综合结构生物学
背景:LINE-1 (L1) 逆转录转座子通过其两个转录本(多功能酶 ORF2p 和分子伴侣 ORF1p)实现的“复制粘贴”机制写入了近一半的人类基因组。ORF2p 的核心包含一个逆转录酶 (RT),其 N 端包含一个结构独立的核酸内切酶 (ENDO) 结构域。ORF1p 是小 RNA 结合结构域的卷曲螺旋三聚体组装体,进一步组装形成细胞中的多聚核糖核蛋白 (RNP) 颗粒。LINE-1 已成为与癌症、自身免疫、神经退行性疾病和衰老有关的潜在治疗靶点。我们最近解决了人类 LINE-1 RT 的第一个晶体结构,表征了催化循环中的不同状态以及与抑制剂结合的催化停滞状态。结合对 Line-1 ENDO 和 ORF1p 结构的访问,这使我们能够采取综合发现方法,合理设计调节 LINE-1 功能各个方面的小分子,以满足不同治疗适应症的细微要求。
利用基因打靶和主要编辑对植物进行精准基因组编辑:现有和新兴策略
精确修改植物基因组(例如在预定位点无缝插入、删除或替换 DNA 序列)是一项具有挑战性的任务。基因靶向和主要编辑是目前实现此目的的最佳方法。然而,这些技术在植物中效率低下,这限制了它们在作物育种计划中的应用。最近,人们取得了重大进展,以提高这些技术在植物中的效率。RNA 供体模板、化学修饰的供体 DNA 模板和串联重复同源定向修复等几种策略旨在改善基因靶向。此外,改进的主要编辑 gRNA 设计、使用工程逆转录酶和分裂主要编辑组件提高了植物中主要编辑的效率。本文回顾了这些新兴策略和现有技术,并对其未来改进和开发强大的植物精确基因组编辑技术进行了各种展望。关键词:CRISPR/Cas、精确基因组编辑、基因靶向、主要编辑、植物
用于癌症诊断和治疗的肿瘤靶向荧光标记系统
缩写:Ad5,腺病毒 5 型;Ad35,腺病毒 35 型;AFP,甲胎蛋白;CAR,柯萨奇病毒和腺病毒受体;CEA,癌胚抗原;CTC,循环肿瘤细胞;ctDNA,无细胞肿瘤 DNA;EGFP,增强型绿色荧光蛋白;EMT,上皮-间质转化;EV,细胞外囊泡;FSP1,成纤维细胞特异性蛋白 1;GFP,绿色荧光蛋白;HCC,肝细胞癌;HSV1,人类单纯病毒 1 型;hTERT,人类端粒酶逆转录酶;Id1,DNA 结合抑制剂 1;IL-1β,白细胞介素-1β;miRNA,微小 RNA;PDAC,胰腺导管腺癌;PDT,光动力疗法;PSA,前列腺特异性抗原;PSES,前列腺特异性增强子序列; PSMA,前列腺特异性膜抗原;RFP,红色荧光蛋白;ROS,活性氧;SEAP,分泌性胚胎碱性磷酸酶;TME,肿瘤微环境。
肽融合提高主要编辑效率 1
Prime editing 是一种基于 CRISPR 的“搜索和替换”技术,可在没有双链断裂 (DSB) 或供体 DNA 模板 1 的情况下,在哺乳动物细胞中介导靶向 32 插入、删除和所有可能的碱基对碱基转换。Prime editing 34 酶 (PE2) 由与工程逆转录酶 (RT) 融合的 SpCas9 切口酶组成。35 PE2 通过 Prime editing 向导 RNA (pegRNA) 被招募到目标位点,该 RNA 除了标准基因组靶向间隔区和 SpCas9 结合发夹结构外,还包含 3' 序列,37 该序列充当融合 RT 的模板,以在一条切口 DNA 链上合成编程的 DNA 序列。当细胞 DNA 修复机制修复断裂的链时,这种 RT-39 延伸片段会与未编辑的片段竞争,而编辑后的序列有时会取代基因组中的原始序列 1,2。41
催化这些非模板的核酸研究......
摘要 DNA 聚合酶以模板指导的方式催化脱氧核苷酸添加到 DNA 引物上。模板指导的要求将这些酶与其他不利用模板的核苷酸转移酶(如末端脱氧核苷酸转移酶)区分开来。寡核苷酸底物用于表征来自各种原核生物和真核生物来源的 DNA 聚合酶进行的新型非模板核苷酸添加反应。通过在高分辨率变性聚丙烯酰胺凝胶上进行电泳分析反应产物,其中脱氧核苷酸被添加到平端 DNA 底物的 3' 羟基末端。来自 Ihermus aguaticus 的 DNA 聚合酶、来自鸡胚的聚合酶 a、大鼠聚合酶 B、来自禽类髓母细胞瘤病毒的逆转录酶和来自酿酒酵母的 DNA 聚合酶 I 都进行平端添加反应。该反应需要双链 DNA 底物,但不需要模板链的编码信息。这些结果表明,模板指令不是 DNA 聚合酶催化核苷酸转移反应的绝对要求。