XiaoMi-AI文件搜索系统
World File Search System会议 (ASCO),美国芝加哥。2022 年 6 月 3 日至 7 日。AFM24 与阿替利珠单抗联合治疗晚期
- EGFR 型非小细胞肺癌 (NSCLC),在接受 ≥1 种先前治疗后出现进展,包括铂类双药联合治疗或抗 PD -P/ 或抗 PD -L1 抗体治疗•晚期、不可切除或转移性胃/胃食管连接处 (GEJ) 腺癌,接受 ≥1 种先前化疗方案,包括铂类和氟嘧啶双药•晚期或转移性肝细胞癌、肝胆管癌或胰腺腺癌:接受过 ≥1 种针对相应疾病类型的已获批准的标准治疗疗法或不符合标准治疗条件•血液学、肝脏和肾脏功能良好•东部肿瘤协作组 (ECOG) 体能状态 (PS) 为 0 或 1•根据实体肿瘤反应评估标准 (RECIST v1.1) 可评估或测量疾病关键排除标准•
2021; 12(8): 2295-2316. doi: 10.7150/jca.53395 卵巢透明细胞癌发病机制、诊断和治疗观点的综述更新
卵巢透明细胞癌(OCCC)是上皮性卵巢癌(EOC)的一种特殊病理类型,在亚洲发病率很高,无特定的分子亚型分类。子宫内膜异位症是公认的癌前病变,患OCCC的风险增加3倍。卵巢子宫内膜样癌也起源于子宫内膜异位症,与OCCC有几个共同点,包括铂类耐药和诊断年龄较低。与其他EOC相比,OCCC患者发生静脉血栓栓塞症(VTE)的风险约为2.5至4倍,且OCCC倾向于通过淋巴小泡和腹膜播散而不是血源性转移。传统生物标志物CA125仅轻度升高。分期手术或最佳细胞减灭术联合化疗是OCCC的常见治疗策略。但铂类耐药通常预后不良,因此迫切需要新的治疗方法。目前正在研究靶向治疗和免疫治疗,包括PARP、EZH2和ATR抑制剂联合ARID1A缺陷的合成致死,以及MAPK/PI3K/HER2、VEGF/bFGF/PDGF、HNF1 β和PD-1/PD-L1抑制剂。晚期、细胞减灭效果不佳、铂类耐药、淋巴结转移和VTE是OCCC的主要预后预测因素。我们专注于更新发病机制、诊断方法和治疗方法,为OCCC的临床诊断和治疗提供未来方向。
和铂医药控股有限公司HBM Holdings Limited
在此公告之日起,公司仍在最终确定该小组截至2024年12月31日的年度结果。本公告中包含的信息只是董事会的初步评估,基于该小组的未经审核的合并管理帐户止当年截至2024年12月31日目前可供该公司可用的年度,并且不是基于董事会审计委员会(审计委员会审核委员会)审查或确认的任何数字或信息,或审核或审查了该公司或审核的公司。截至2024年12月31日的年度小组的实际结果可能与本公告中披露的结果不同。不得将它们作为该集团当前或未来的运营或财务绩效的量度或指示,也不应将其作为相应数字组的代表作为代表。因此,仅为股东和投资者的参考提供了上述数字。建议股东和潜在投资者仔细阅读截至2024年12月31日的年度公司的年度业绩公告。
硅的拉曼光谱,用铂掺杂并被质子辐照
摘要。在这项工作中,通过拉曼光谱法研究了质子照射和铂杂质对硅样品晶体结构的影响。已经确定,具有铂的Si的单晶掺杂会导致小变化和拉曼光谱中新振动的出现。在521 cm – 1处主硅峰的强度降低了1.6倍,而其FWHM实际上没有变化,约为4.0 cm – 1。这种峰强度的降低可能是由于PT扩散而导致硅晶格结构中键的键和破坏。表明,在Si 光谱中60–280 cm1范围内的新振动的出现与元素PT的存在和PTSI的形成有关。已经发现,具有600 keV质子的Si 样品的照射会导致拉曼光谱发生变化,而PT和/或PTSI的峰消失了。
靶向 SMAC 模拟物 SW IV-134 增强铂...
摘要背景:卵巢癌最初对一线化疗有反应。不幸的是,它经常复发并对现有疗法产生耐药性,晚期和复发性卵巢癌的存活率低得令人无法接受。因此,我们假设通过将顺铂化疗与 SW IV-134(一种针对癌症的肽模拟物和细胞死亡诱导剂)相结合,有可能实现更持久的治疗反应。SW IV-134 是一种最近开发的小分子缀合物,将 sigma-2 配体与内在死亡途径激活剂 SMAC(第二线粒体胱天蛋白酶激活剂)的肽类似物(模拟物)连接起来。sigma-2 受体在卵巢癌中过度表达,缀合物的 sigma-2 配体部分促进癌症选择性。缀合物的效应部分有望与顺铂化疗产生协同作用,癌症选择性有望降低假定的脱靶毒性。方法:卵巢癌细胞系分别用顺铂、SW IV-134 和顺铂联合治疗。使用发光细胞活力测定法确定治疗效果。测量 Caspase-3/7、-8 和 -9 活性作为死亡途径激活的补充指标。研究了人类卵巢癌的同基因小鼠模型和患者来源的异种移植 (PDX) 模型对 SW IV-134 和顺铂单药治疗以及联合治疗的反应。以肿瘤生长率和存活率为主要指标来衡量治疗效果。在尸检时评估潜在的药物相关毒性。结果:与体外单一药物相比,联合治疗在多种细胞系中始终优于单一药物。使用发光和基于流式细胞术的检测系统确认了肿瘤细胞死亡的预期机制,例如 caspase 激活。联合治疗在卵巢癌的同基因和基于 PDX 的小鼠模型中均被证明具有优越性。最值得注意的是,在患者来源的卵巢癌异种移植模型中,联合治疗使所有研究动物的已建立肿瘤完全消退。结论:SW IV-134 与顺铂化疗联合使用是一种有前途的治疗选择,值得进一步进行临床前开发和评估,作为晚期卵巢癌女性的治疗方法。关键词:Sigma-2 受体、Sigma-2/SMAC 药物偶联物、顺铂、联合治疗、卵巢癌
靶向 SMAC 模拟物 SW IV-134 增强铂...
摘要背景:卵巢癌最初对一线化疗有反应。不幸的是,它经常复发并对现有疗法产生耐药性,晚期和复发性卵巢癌的存活率低得令人无法接受。因此,我们假设通过将顺铂化疗与 SW IV-134(一种针对癌症的肽模拟物和细胞死亡诱导剂)相结合,有可能实现更持久的治疗反应。SW IV-134 是一种最近开发的小分子缀合物,将 sigma-2 配体与内在死亡途径激活剂 SMAC(第二线粒体胱天蛋白酶激活剂)的肽类似物(模拟物)连接起来。sigma-2 受体在卵巢癌中过度表达,缀合物的 sigma-2 配体部分促进癌症选择性。缀合物的效应部分有望与顺铂化疗产生协同作用,癌症选择性有望降低假定的脱靶毒性。方法:卵巢癌细胞系分别用顺铂、SW IV-134 和顺铂联合治疗。使用发光细胞活力测定法确定治疗效果。测量 Caspase-3/7、-8 和 -9 活性作为死亡途径激活的补充指标。研究了人类卵巢癌的同基因小鼠模型和患者来源的异种移植 (PDX) 模型对 SW IV-134 和顺铂单药治疗以及联合治疗的反应。以肿瘤生长率和存活率为主要指标来衡量治疗效果。在尸检时评估潜在的药物相关毒性。结果:与体外单一药物相比,联合治疗在多种细胞系中始终优于单一药物。使用发光和基于流式细胞术的检测系统确认了肿瘤细胞死亡的预期机制,例如 caspase 激活。联合治疗在卵巢癌的同基因和基于 PDX 的小鼠模型中均被证明具有优越性。最值得注意的是,在患者来源的卵巢癌异种移植模型中,联合治疗使所有研究动物的已建立肿瘤完全消退。结论:SW IV-134 与顺铂化疗联合使用是一种有前途的治疗选择,值得进一步进行临床前开发和评估,作为晚期卵巢癌女性的治疗方法。关键词:Sigma-2 受体、Sigma-2/SMAC 药物偶联物、顺铂、联合治疗、卵巢癌
miR-139-5p 增强非小细胞肺癌对顺铂的敏感性……
摘要:化疗药物耐药性的产生阻碍了癌症的临床治疗。微小RNA (miRNA/miR) 已被证明在许多类型癌症的耐药性中起着至关重要的作用。先前报道称 miR-139-5p 与人鼻咽癌细胞和结直肠癌细胞的顺铂 (DDP) 敏感性有关。然而,miR-139-5p 对非小细胞肺癌 (NSCLC) 细胞 DDP 敏感性的影响和潜在机制尚未完全阐明。在本研究中,通过逆转录定量聚合酶链反应 (RT-qPCR) 和蛋白质印迹法检测 NSCLC 组织中 miR-139-5p 和同源框蛋白 Hox-B2 (HOXB2) 的表达。随后,研究了 miR-139-5p 对体外 NSCLC 细胞 DDP 敏感性的影响。使用 Cell Counting Kit-8 检测细胞增殖情况,Western blotting 检测 HOXB2、磷酸化 (p)-PI3K、p-AKT、caspase-3 和 cleaved-caspase-3 的蛋白表达,RT-qPCR 检测 miR-139-5p 的表达以及 HOXB2、PI3K、AKT 和 caspase-3 的 mRNA 表达水平。流式细胞术检测细胞凋亡率。结果表明,NSCLC 组织中 miR-139-5p 的表达显著低于癌旁组织。此外,miR-139-5p 通过调节 PI3K/AKT/caspase-3 信号通路,增加细胞凋亡,抑制 DDP 诱导的 NSCLC 细胞增殖。此外,HOXB2 被确定为
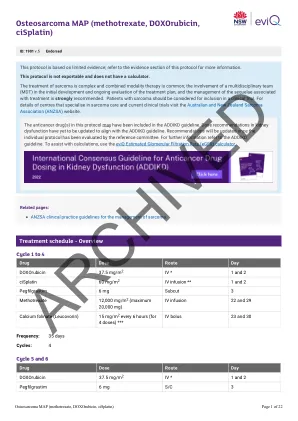
骨肉瘤图(甲氨蝶呤,阿霉素,顺铂)
剂量修改的证据是有限的,EVIQ提出的建议仅作为指导。他们通常是保守的,重点是安全。任何剂量修改均应基于临床判断,以及个体患者的状况,包括但不限于治疗意图(治愈性与姑息治疗),抗癌治疗方案(单一对组合疗法与化学疗法与化学疗法与免疫疗法),癌症的生物学,癌症,大小,突变,转移酶的其他副作用,良好的效果,表现良好,效果和其他副作用,表现为其他。修改基于临床试验结果,产品信息,已发表的指南和参考委员会共识。降低剂量适用于每个单独剂量,除非另有说明,否则不适用于治疗周期的总天数或持续时间。非血液学等级基于不良事件的共同术语标准(CTCAE),除非另有说明。肾脏和肝剂量修饰已在可能的情况下进行标准化。有关更多信息,请参见剂量注意事项和免责声明。
IJMS-25-08568(1).pdf
摘要:神经内分泌肿瘤(NENS)是一组具有共同表型的恶性肿瘤,但预后有所不同,对当前治疗的反应有所不同。基于它们的形态特征和增殖速率,可以将NEN分为两个主要组,具有不同的临床行为和对治疗的反应:(i)良好的分化神经内分泌肿瘤(网络)或类癌(较低的增殖率),以及(ii)较差的小细胞或大细胞神经(II)(ii)(II) 速度)。对于某些NEN(例如胰腺肿瘤,高级肿瘤以及患有DNA损伤修复缺陷的肿瘤),化学疗法是主要的治疗方法。在不同的化学疗法剂中,顺铂和卡铂与依托泊苷结合使用,与网络相比,在治疗NEC方面表现出最大的功效。顺铂和卡铂的细胞毒性作用主要是由于它们与DNA的结合,这会干扰正常的DNA转录和/或复制。与此相一致的是,NEC通常在DNA修复中涉及的途径中具有突变(例如RB,MDM2,BRCA和PTEN),对基于铂的化学疗法具有很高的反应。识别影响NENS引发和进展的分子途径的突变对于预测对铂化学疗法的反应至关重要。本综述旨在强调可靶向的突变,这些突变可以作为对NENS基于铂的化学疗法的治疗反应的预测指标。
胆碱激酶抑制剂 MN58b 和 RSM932A 增强...
摘要:肺癌是发达国家的主要死亡原因之一,非小细胞肺癌(NSCLC)是最常见的类型(占患者的 80%)。对于晚期 NSCLC,以铂类为基础的化疗是一线姑息治疗,但不到 5% 的患者能够延长生存期。最近,免疫疗法已被提议作为晚期 NSCLC 的标准治疗(SoC),无论是单一疗法还是与化疗联合使用。PD-L1 的表达水平是评估患者的唯一预测性生物标志物。虽然接受免疫治疗的患者中约有 30% 实现了 5 年生存,但相当一部分患者并没有从这种新的治疗方法中受益。因此,需要新的策略来改善临床结果。胆碱激酶 α(ChoK α)的表达水平在大量人类肿瘤中增加,包括 NSCLC 肿瘤,并且构成早期 NSCLC 患者的独立预后因素。因此,ChoK α 已被假定为癌症治疗中的一种新靶向药物。顺铂与胆碱激酶抑制剂等新型靶向药物的组合可以提高 NSCLC 患者的生存率和生活质量,并可以作为开发新治疗方法的基础。为此,我们开发了几种体外和体内方法来评估使用顺铂和 ChoK α 抑制剂的新型组合方案的抗肿瘤活性。我们的结果表明,NSCLC 预后因子 ChoK α 的特定抑制剂与铂类常规化疗的适当组合可能成为一种新的、有效的 NSCLC 患者治疗方法。这种新方法可能有助于降低与顺铂相关的毒性,因为尽管近年来 NSCLC 管理取得了进展,但总体 5 年生存率仍然很低。