机构名称:
¥ 1.0
根据 SEC 疫苗会议于 2023 年 6 月 27 日提出的建议,CDSCO 对临床试验地点进行了检查。委员会注意到了检查结果。经过详细审议,根据检查结果和提交的临床研究报告,委员会建议授予重组戊型肝炎疫苗的进口许可,适用于 18 岁至 65 岁年龄组,条件是至少对 1000 名受试者进行以安全性和免疫原性为主要终点的 IV 期临床试验。IV 期临床试验方案应在 2 个月内提交,并应立即提交该试验的数据以继续获得进口和上市许可。2 结核分枝杆菌(减毒活疫苗)[II 期临床试验方案] [BIO/CT/24/000042]
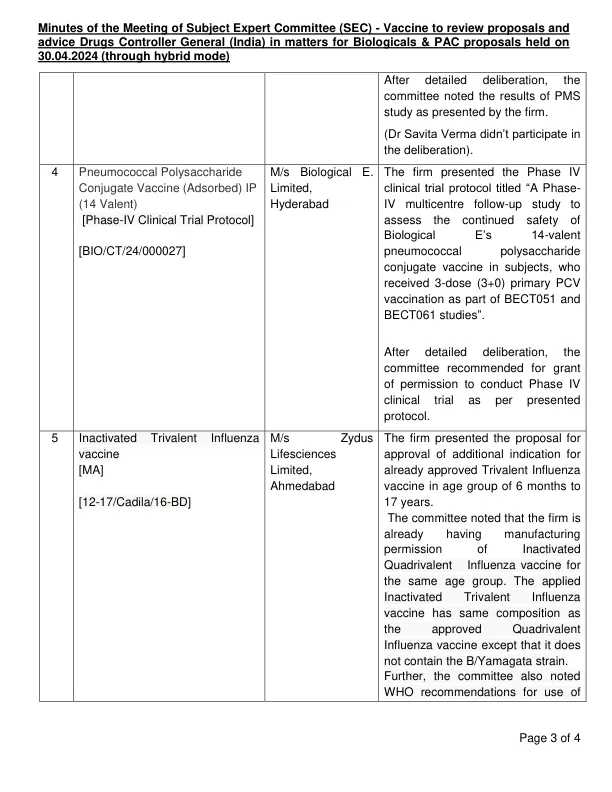
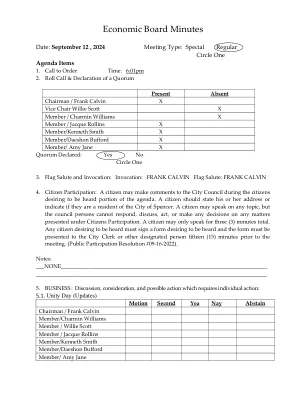
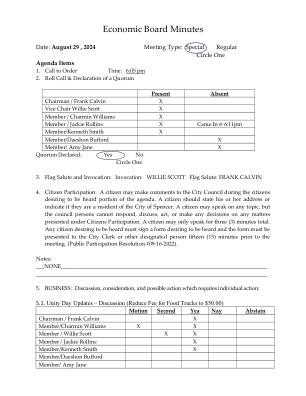
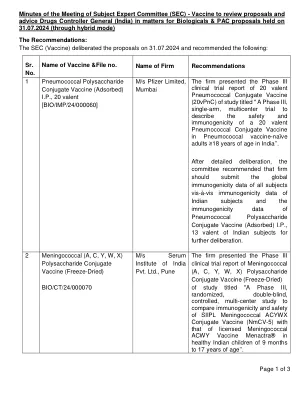
学科专家委员会(SEC)会议纪要