机构名称:
¥ 1.0
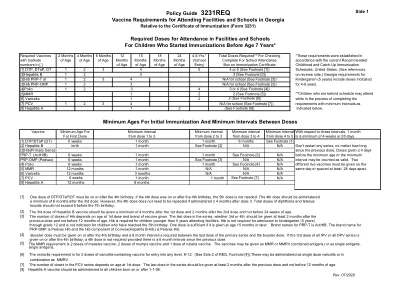
- 传代水平 - 血凝素和神经氨酸酶的特性 - 分析方案(包括种子批次的测试结果)* 3.2.S.2.4 关键步骤和中间体的控制 3.2.S.2.5 工艺验证和/或评估 - 单价批量: - 生产工艺菌株的具体变化 - 关键生产步骤的验证(新菌株) 1. 灭活 2. 分裂效率 3.2.S.3 特性(特性研究的选择,如粒度分布、聚集体的存在等) 3.2.S.4.1 规范(表格格式的已批准规范的副本) 3.2.S.4.2 分析程序 3.2.S.4.3 分析程序的验证(新菌株的 SRD 测试验证) 3.2.S.4.4 单价批量的批次分析结果:来自新主菌株的每个工作种子批次的前三个单价批量的结果(包括神经氨酸酶测试)新菌株的种子批次 - 每个工作种子批次均来自先前批准的主种子批次,其中工作种子批次的制备程序与批准的程序不同 3.2.S.7 药物物质:稳定性(活性物质的稳定性测试:使用一年以上的单价散装的结果)3.2.P.1 成分 3.2.P.2.2.1 药物开发:配方开发(实际配方(新季节菌株)和如果已要求临床试验来支持“年度”更新,则提供临床试验中使用的批次分析证书(如有)(第一步或第二步提交)3.2.P.3.2 批次配方(实际配方)3.2.P.5.1 规格(以表格形式复制批准的规格和常规测试分析方法)3.2.P.5.3 分析程序的验证;对新菌株进行 SRD 测试验证(使用三价散装或药物产品)3.2.P.8 药物产品:稳定性 - 上一季的稳定性数据 - 稳定性承诺 - 最终批次的批准后稳定性方案稳定性
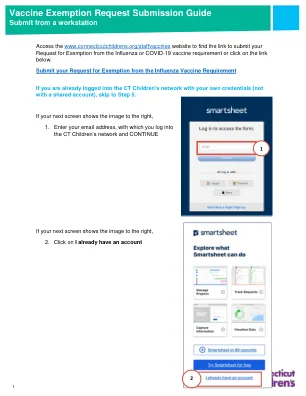
流感疫苗指南 - 提交和程序要求
主要关键词