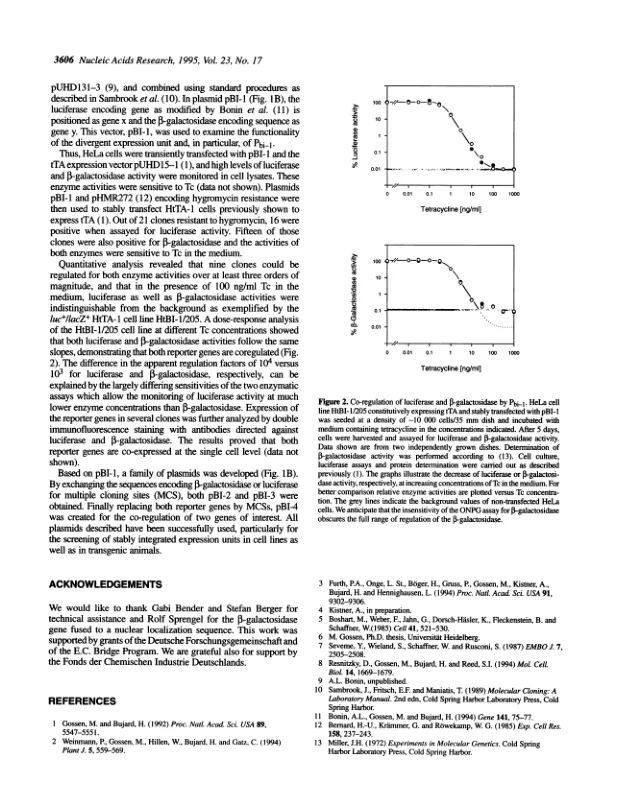
最近,我们描述了一个调节系统,该系统允许在较高的真核细胞系(1),植物(2)和动物(3,4)中严格控制单个基因活性。该系统的基本组件是(i)一个RNA聚合酶H最小启动子,放置在多个操作序列(TETO)的下游,其大肠杆菌tnjo Tetracycline抗性操纵子和(ii)TET抑制剂(TET)(TETR)和Simples Simples Simplex Virus Protein 16(vpp16(vp p p p)(ii)(ii)(ii)融合。在不存在四环素(TC)的情况下,TTA与TET算子结合以激活最小启动子的转录,而在TC存在下,它的关联并因此阻止了其转录激活。在TTA结合后,源自巨细胞病毒IE启动子(PHCMV,5)的最小启动子,并融合到七个TETO序列中,当在短暂性表达测定中进行比较时,在HELA细胞中的父启动子的明显强度达到了显着的强度(6)。TTA的高激活潜力及其结合位点在PHCMV*_1 [(1)中的排列;参见图ia]建议设计双向启动子,该设计将允许同时调节来自中心位置多个TETO序列的两个转录单元(图la)。这样的启动子对于多种实验方法应该有用。首先,它可以允许以化学计量量的两种基因产物的合成,这通常是产生异二聚体(或异源 - 寡聚)蛋白的先决条件。在这里,我们报告了双向启动子的构建(PBI-L;图第二,通过将不同效率的最小启动子融合到中心位置的TETO序列,可以在不同但定义的水平上共同调节两个基因产物。第三,通过在双向启动子的一侧整合适当的报告基因,可以通过报告基因函数来监测对不可读基因的调节。后一种可能性也可能有助于在细胞和有机水平上 - 筛选正确整合的表达单元,以控制感兴趣的基因。1a)表明,该启动子以定量方式共同调节了编码P-半乳糖苷酶和荧光素酶的两个报告基因。此外,我们描述了一个矢量系列,很容易允许将PBI-I用于各种目的。图1a所示的广义发散转录单元由基因X的双向启动子组成,然后是
通过双向启动子通过四环素共同调节两个基因活性通过双向启动子通过四环素共同调节两个基因活性
主要关键词