XiaoMi-AI文件搜索系统
World File Search SystemYKL-40促进Ⅱ型肺泡上皮细胞A549炎症因子的表达*
△通讯作者,电子邮件:xieqibing1971@163.com tractramp a摘要】客观YKL-40,也称为Chitinase-3-like-1(CHI3L1),是人类软骨糖蛋白-39,是N-末端,其N-末端由酪氨酸(Y)(Y),Lysine(y),Lysine(k),Lysine(k),k),lysine(k),k)和lecine(k),k) YKL-40。在这项研究中,我们探讨了YKL-40是否可以促进肺泡上皮细胞中炎症因子的表达。方法A549细胞在体外用白介素(IL)-1β(20 ng/ml),IL-6(20 ng/ml),肿瘤坏死因子-Alpha(TNF-α)(20 ng/ml)(20 ng/ml)和Interferon-gamma(Interferon-gamma(Ifn-γ)(IFN-γ/ml)。通过RT -QPCR确定YKL -40转录的表达。A549细胞,YKL-40蛋白的表达通过蛋白质印迹确定。A549细胞在0、100、500和1000 ng/ml的重组YKL-40蛋白培养,IL-6和IL-8的表达水平。设计并分别用于转染A549细胞,三对靶向YKL-40(SI-YKL -40-1/2/3)和阴性对照(NC)的三对小型RNA,分别用于转染A549细胞,并通过RT-QPCR和Western Blot确定YKL-40的表达。si-ykl -40-3被筛选出来以进行后续实验。在A549细胞中,转染Si-YKL -40-3和Si-NC,然后添加IL-1β(20 ng/ml)进行培养。通过RT-QPCR确定YKL -40,IL -6和IL-8的表达,并用QAH-INF-1 KIT测量上清液中多个因子的表达。结果RT-QPCR结果表明,与对照组相比,IL-1β可以上调YKL-40蛋白转录水平,并且差异具有统计学意义(p <0.01),但是IL-6,TNF-α和IFN-γ无法上调YKL-40蛋白质转录水平。Western印迹结果表明,IL-1β(20 ng/ml)可以显着促进YKL-40的表达,并且与对照组相比,用不同浓度的IL-1β进行处理的差异均具有统计学意义(P <0.01)。在将人类重组YKL-40蛋白添加到A549细胞中后,结果表明,与对照组相比,炎症因子IL-6和IL-8的表达显着增加,并且差异在统计学上显着(p <0.05)。通过SI-YKL -40-3转染降低YKL-40的表达后,IL-6(P <0.05)的表达(P <0.05),IL-8(P <0.05)和其他炎症因子被抑制与
子宫内膜上皮细胞中失调的 miR-124-3p...
子宫接受性对于胚胎植入和成功怀孕至关重要。由于子宫接受性受损而导致的植入失败是导致不孕的重要原因,但目前尚无检测方法可以识别子宫内膜引起的不孕症。在这项研究中,我们证明了在接受期,不孕女性的子宫上皮中 microRNA - 124 - 3p 异常升高。我们开发了两种模型:一种基因诱导的子宫上皮特异性 microRNA - 124 - 3p 过表达小鼠模型和一种三维人类胚胎滋养外胚层 - 子宫内膜细胞共培养模型。利用这些模型,我们发现小鼠和人类中升高的 microRNA - 124 - 3p 会破坏子宫内膜上皮细胞的粘附和极性,从而阻止子宫上皮过渡到接受状态。这项研究将 microRNA - 124 - 3p 确定为子宫内膜引起的不孕症的诊断和治疗靶点。
批准的Sirolimus类似于周围的上皮细胞CE
摘要这项研究研究了血管周围上皮细胞肿瘤(PECOMA)的精确医学,重点是FDA批准的Sirolimus类似物的重新定位潜力。整合了转录组的见解和结构分析,该研究确定了与已建立的Pecoma治疗相似之处的类似物。结构改进增强了我们对药物靶标相互作用的理解,从而揭示了通过空腔检测的潜在结合位点。盲区对接阐明了相互作用模式和亲和力,突出了西罗莫司(Sirolimus)与有前途的候选者相似的pecoma候选者。这种综合方法为有效利用这些热霉素在pecoma治疗中,为进一步的实验和临床探索开放了至关重要的知识。关键词:周围性上皮细胞肿瘤,西洛里木斯,转录组洞察力,药物 - 药物相似性分析,腔体导的盲码头,重新定位。国际药物输送技术杂志(2023); DOI: 10.25258/ijddt.13.4.12 How to cite this article: Mujawar T, Kayande N, Thube U, Belhekar S, Deshmukh N, Tare H. Unlocking Therapeutic Potential: A Comprehensive Exploration of FDA-Approved Sirolimus similars for Perivascular Epithelioid Cell Tumor Treatment through Transcriptomic Insight, Structural Integration, and药物引导盲对接的药物 - 药物相似性分析。国际药物输送技术杂志。2023; 13(4):1194-1198。支持来源:零。利益冲突:无
秀丽隐杆线虫肠上皮细胞对病毒感染的先天免疫
简历和讨论摘要:本申请提议在先前的研究工作的基础上,确定秀丽隐杆线虫中抗病毒信号传导和 RNA 免疫传感途径的机制。该提案具有重要意义,因为它试图通过确定秀丽隐杆线虫中可诱导的抗病毒和抗真菌反应来增进我们对先天免疫反应的理解。该申请的其他主要优势包括一支经验丰富的研究人员团队,他们在 RNA 测序和细胞内病原体反应途径方面拥有专业知识。研究方法包括全面讨论先前研究的严谨性、开发用于探索细胞内病原体反应途径的独特工具的技术创新。有大量令人信服的初步数据支持这项工作的可行性,对潜在的陷阱和替代方法进行了充分的描述。总体而言,审查小组对这一强大的申请表现出很高的热情。
使用hipsc-airway上皮细胞移植的大鼠SARS-COV-2的感染模型
研究气道上皮中严重急性呼吸综合征2(SARS-COV-2)的感染机制,并制定针对感染的有效防御策略很重要。为实现这一目标,建立适当的感染模型至关重要。因此,各种体外模型,例如细胞系和培养物,以及涉及表现出SARS-COV-2感染和遗传性人类动物的动物的体内模型,已被用作动物模型。但是,尚未建立动物模型,该模型允许在气道上皮生理环境下对人类细胞进行感染实验。因此,我们旨在建立一种新型的动物模型,该模型可以使用人类细胞进行感染实验。使用了人类诱导的多能干细胞衍生的气道上皮细胞移植的裸鼠(HIPSC-AEC大鼠),并通过喷洒含有SARS-COV-2峰值蛋白质的慢病毒假病毒来进行感染研究。感染后,免疫组织化学分析揭示了上皮和粘膜下层中GFP阳性感染的移植细胞的存在。在这项研究中,建立了包括人类细胞在内的SARS-COV-2感染动物模型通过呼吸模仿感染,我们证明HIPSC-AEC大鼠可以用作基础研究的动物模型,并开发了人类特异性呼吸道治疗方法的治疗方法。
抗体的表面结合可改善支气管上皮细胞对纳米颗粒的吸收
分子治疗的进步使得通过全身或局部给药进行基因编辑成为合理治疗遗传疾病的可行策略。将治疗剂封装在纳米颗粒中可以改善治疗剂的细胞内输送,前提是纳米颗粒能有效地被靶细胞吸收。在之前的工作中,我们已经建立了原理证明,即携带基因编辑试剂的纳米颗粒可以在胎儿和成年动物体内介导位点特异性基因编辑,从而改善啮齿动物 β-地中海贫血和囊性纤维化模型的功能性疾病。对纳米颗粒表面进行修饰以包括靶向分子(例如抗体)有望改善细胞吸收和特定细胞结合。
DNA损伤在肾小管上皮细胞损伤中的作用
从脑电图(EEG)信号中解码人的手移动对于开发主动的人类增强系统至关重要。尽管现有研究为从EEG信号解码单手运动方向做出了很大的贡献,但在相反的手移动条件下解码主要的手移动方向仍保持开放。在本文中,我们研究了基于相反手移动下的EEG信号的主要手部运动方向的神经特征,并基于运动相关皮质电位(MRCP)的非线性动力学参数开发了一种新颖的解码方法。实验结果表明,在相反的手移动下,手动运动方向之间MRCP的显着差异。此外,在相反的手运动状态下,提出的方法的表现良好,平均二元解码精度为89.48±5.92%。这项研究可能为上肢的未来发展的人类增强系统奠定了基础,损害了患者和健康的人,并开辟了新的途径,以从EEG信号中解释其他手移动参数(例如,速度和位置)。
从口腔上皮细胞、头发、指甲和唾液中提取人类基因组 DNA
OA2ω,/A280 比率仅为 1/140 和 1/85,分别为 1.54±0.43 和 1.51±0.21。
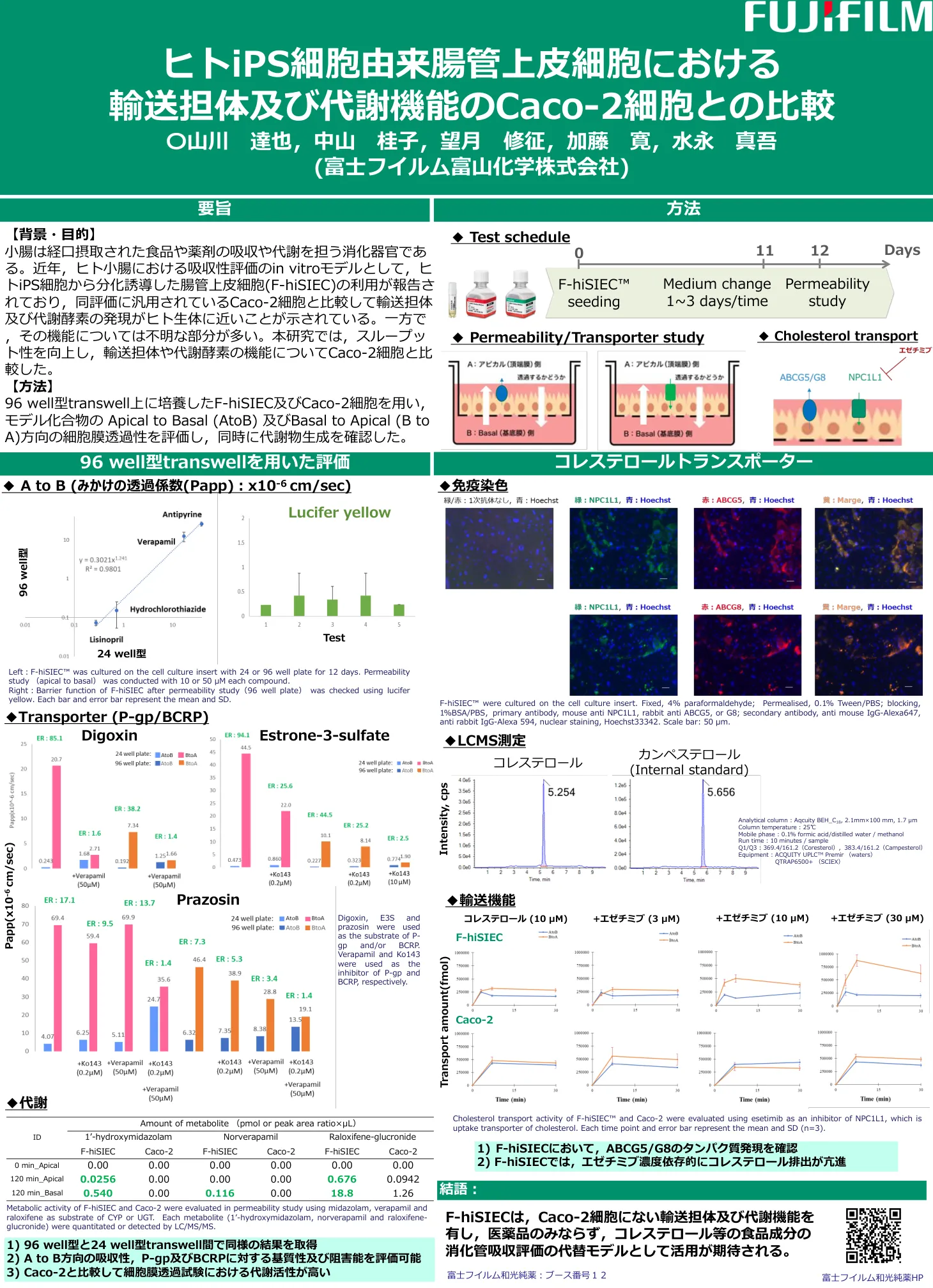
人类 iPS 细胞衍生的肠上皮细胞中的转运蛋白和代谢...
[背景与目的] 小肠是负责口服食物和药物的吸收和代谢的消化器官。近年来,有报道称利用由人类iPS细胞分化而来的肠上皮细胞(F-hiSIEC)作为评价人体小肠吸收情况的体外模型,结果显示其转运载体和代谢酶的表达比通常用于该评价的Caco-2细胞更接近人体。然而,其功能的许多方面仍然未知。本研究提高了通量,并将运输载体和代谢酶的功能与Caco-2细胞进行了比较。 [方法] 利用在96孔Transwell中培养的F-hiSIEC和Caco-2细胞,评估了模型化合物从顶端到基底(A到B)和从基底到顶端(B到A)方向的细胞膜通透性,并同时确认了代谢物的产生。
通过乳腺导管内注射将基因递送至小鼠乳腺上皮细胞
小鼠乳腺由导管树组成,导管树内衬上皮细胞,每个乳头顶端都有一个开口。上皮细胞在乳腺功能中起着重要作用,是大多数乳腺肿瘤的起源。将感兴趣的基因引入小鼠乳腺上皮细胞是评估上皮细胞基因功能和生成小鼠乳腺肿瘤模型的关键步骤。这一目标可以通过将携带感兴趣基因的病毒载体注射到小鼠乳腺导管树中来实现。注射的病毒随后感染乳腺上皮细胞,带来感兴趣的基因。病毒载体可以是慢病毒、逆转录病毒、腺病毒或腺病毒相关病毒 (AAV)。这项研究展示了如何通过小鼠乳腺导管内注射病毒载体将感兴趣的基因传递到乳腺上皮细胞中。携带GFP的慢病毒用于显示传递基因的稳定表达,携带Erbb2(HER2/Neu)的逆转录病毒用于显示致癌基因诱导的非典型增生性病变和乳腺肿瘤。