XiaoMi-AI文件搜索系统
World File Search System人乳头瘤病毒疫苗接种对感染率的影响...
高级别细胞学和组织学发病率将受到种族影响。次要假设与未接种疫苗的女性相比,18 岁之前接种疫苗的女性的 (a) 低级别细胞学和 (b) 低级别组织学发病率较低。统计分析使用 STATA(StataCorp. 2013. Stata 统计软件:第 13 版。德克萨斯州大学城:StataCorp LP)进行双样本比例检验以比较比例。为了比较高级别细胞学和组织学发病率的组间差异,在 R 版本 3.5.2 中实施了发病率比 (IRR) 分析(R 核心团队。2013. R:统计计算语言和环境。R 统计计算基金会,奥地利维也纳。URL http://www.R-project.org/)。显着性水平设定为 alpha = 0.05。报告的置信区间为百分之九十五。
人乳头瘤病毒 (HPV) 疫苗重新分类
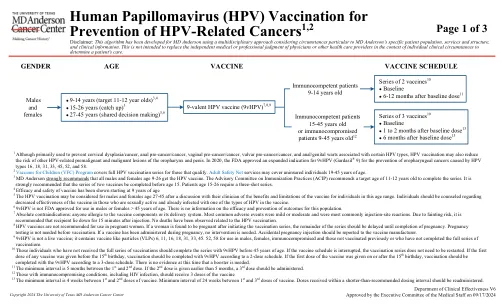
接种疫苗的最佳年龄是青春期早期,即在通过性接触接触 HPV 之前。但是,该计划资助的疫苗接种年龄直至 26 岁,以最大限度地发挥对人口的影响 [1]。对于 13 至 26 岁的青少年和成年人,如果之前未接种过疫苗或未完成疫苗接种系列,建议补种疫苗。对于有证据表明之前感染过 HPV 的推荐年龄范围内的年轻人,仍然建议接种疫苗,因为疫苗仍然可以提供针对尚未接种的 HPV 疫苗类型的感染的保护 [7]。临床试验发现,新西兰提供的 HPV 疫苗 Gardasil 安全且高效 [8]。不良事件通常是轻微和短暂的,包括注射部位疼痛、昏厥(通常与针头有关)和头晕 [9, 10]。自 10 多年前(针对女性)和 2017 年(针对男性)推出 HPV 免疫计划以来,疫苗特异性 HPV 的流行率已显着降低。在新西兰,项目启动七年后,生殖器疣发病率降低了 61% [11]。在澳大利亚,三剂疫苗接种覆盖率超过 80%(女性)和 76%(男性),患生殖器疣的年轻女性减少了 90% 以上 [12, 13]。高危 HPV 显著下降导致宫颈癌前病变发病率大幅下降,这表明在新西兰等实施有组织的全民项目的国家,消除宫颈癌是可能的 [1, 14]。据估计,如果疫苗接种覆盖率高、公平且可持续,HPV 疫苗接种每年有望预防 2300 多例宫颈癌和宫颈癌前病变 [15],并减少癌症不平等现象 [16]。毛利女性的宫颈癌发病率大约是新西兰欧洲女性的两倍。提高疫苗接种率被认为是减少宫颈癌差异的最有效策略之一,也是新西兰癌症控制的重点 [16, 17]。药剂师作为 HPV 疫苗接种提供者:提高新西兰年轻人的疫苗接种机会和接种率
接种人乳头瘤病毒 (HPV) 疫苗可预防...
3 MD Anderson 强烈建议所有 9-26 岁的男性和女性接种 HPV 疫苗。免疫实践咨询委员会 (ACIP) 建议完成该系列疫苗接种的目标年龄为 11-12 岁。强烈建议在 15 岁之前完成两剂疫苗系列接种。15-26 岁的患者需要接种三剂疫苗。4 疫苗的有效性和安全性已从 9 岁开始得到证实 5 在与临床医生讨论该年龄段人群接种疫苗的益处和局限性后,可考虑为 27-45 岁的男性和女性接种 HPV 疫苗。应告知个人,对于有性生活且已感染疫苗中一种 HPV 类型的人,疫苗的有效性会降低。6 9vHPV 未获得 FDA 批准用于 45 岁以上的男性或女性。没有关于该人群的有效性和预防结果的信息。 7 绝对禁忌症:对疫苗成分或其输送系统过敏的人。最常见的不良事件是轻度或中度的,最常见的是注射部位反应。由于存在昏厥风险,建议接种者在注射后躺下 15 分钟。尚未观察到与 HPV 疫苗接种相关的死亡病例。8 不建议孕妇使用 HPV 疫苗。如果女性在开始接种疫苗系列后发现怀孕,则应将剩余的疫苗系列推迟到怀孕完成。接种疫苗前无需进行妊娠测试。如果在怀孕期间接种了疫苗,则无需干预。意外怀孕注射应报告给疫苗制造商。9 9vHPV 不是活疫苗;它含有疫苗样颗粒 (VLP) 6、11、16、18、31、33、45、52、58,适用于男性、女性、免疫功能低下者和之前未接种过疫苗或未完成全系列疫苗接种的人。10 未接种全系列疫苗的个人应在 45 岁之前完成 9vHPV 系列疫苗接种。如果疫苗接种计划中断,则无需重新开始疫苗接种系列。如果任何疫苗的第一剂是在 15 岁生日之前接种的,则应按照 2 剂计划完成 9vHPV 疫苗接种。如果第一剂疫苗是在 15 岁生日当天或之后接种的,则应按照 3 剂计划完成 9vHPV 疫苗接种。目前没有证据表明需要加强针。11 第 1 剂和第二剂之间的最短间隔为 5 个月。如果第 2 剂接种时间早于 5 个月,则应接种第 3 剂。12 免疫功能低下者(包括 HIV 感染者)应接种 3 剂疫苗 13 第 1 剂与第 2 剂疫苗接种间隔最短为 4 周。第 1 剂与第 3 剂疫苗接种间隔最短为 24 周。如果在比推荐给药间隔短的时间内服用了药物,应重新服用。
澳大利亚人的人乳头瘤病毒(HPV)疫苗
建议使用12-13岁的青少年进行HPV疫苗,并包括在澳大利亚国家免疫计划(NIP)中。它是通过该年龄段的学校计划以一剂量时间表提供的。在13岁时未接受HPV疫苗剂量的人有资格获得资助剂量,直到25岁。建议使用单剂量的HPV疫苗。建议对具有明显的免疫掌握条件的个体制定三剂时间表,并以0、2和6个月的间隔给予剂量。开始进行性活动之前接种疫苗的人将从HPV疫苗接种中受益最大。通常不建议使用≥26岁的成年人进行HPV疫苗接种,但建议与男性和患有明显的免疫功能障碍的男性发生性关系,无论年龄如何。建议针对年龄≥26岁的成年人制定三剂时间表,并以1、2和6个月的间隔给予剂量。
人工智能通过眼底照片检测视乳头水肿
结果 来自 6779 名患者的训练和验证数据集包括 14,341 张照片:9156 张正常视盘、2148 张有视乳头水肿的视盘和 3037 张有其他异常的视盘。分类为正常的百分比在各个部位从 9.8% 到 100% 不等;分类为有视乳头水肿的百分比在各个部位从 0 到 59.5% 不等。在验证集中,系统以 AUC 为 0.99(95% 置信区间 [CI],0.98 至 0.99)区分有视乳头水肿的视盘与正常视盘以及有非视乳头水肿异常的视盘,以 AUC 为 0.99(95% CI,0.99 至 0.99)区分正常视盘与异常视盘。在 1505 张照片的外部测试数据集中,该系统对视乳头水肿检测的 AUC 为 0.96(95% CI,0.95 至 0.97),灵敏度为 96.4%(95% CI,93.9 至 98.3),特异性为 84.7%(95% CI,82.3 至 87.1)。
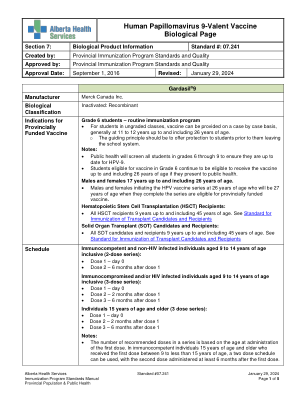
07.241 人乳头瘤病毒疫苗生物学页面
6 年级学生 – 常规免疫计划 • 对于不分年级的学生,可根据具体情况提供疫苗,一般在 11 至 12 岁至 26 岁之间。o 指导原则是在学生离开学校系统之前为他们提供保护。注意: • 公共卫生部门将筛查 6 至 9 年级的所有学生,以确保他们及时接种 HPV-9。• 6 年级有资格接种疫苗的学生如果向公共卫生部门报到,则在 26 岁之前继续有资格接种疫苗。17 岁至 26 岁的男性和女性。• 26 岁时开始接种 HPV 疫苗系列的男性和女性,在完成该系列时将年满 27 岁,有资格接种省级资助的疫苗。造血干细胞移植 (HSCT) 接受者: • 年龄在 9 岁至 45 岁之间的所有 HSCT 接受者。请参阅移植候选者和接受者的免疫接种标准 实体器官移植 (SOT) 候选者和接受者: • 年龄在 9 岁至 45 岁之间的所有 SOT 候选者和接受者。请参阅移植候选者和接受者的免疫接种标准
关于人乳头瘤病毒 (HPV) 和 HPV 疫苗的常见问题
什么是人乳头瘤病毒 (HPV)?人乳头瘤病毒 (HPV) 是一种常见的病毒,可感染男性和女性。HPV 通过皮肤接触传播,例如性活动期间的密切生殖器接触。HPV 感染的风险是什么?HPV 感染通常不会引起症状。HPV 有 200 多种不同的菌株,分为可能导致癌症的高危菌株和不会导致癌症的低危菌株。高危菌株与宫颈癌和其他癌症有关,例如阴道癌、外阴癌、口腔癌、肛门癌和阴茎癌。其他低危菌株可能导致生殖器、口腔或其他皮肤疣。在大多数情况下,感染可以被人体免疫系统清除。但是,有时感染会持续存在并导致细胞异常变化,并可能发展成癌症。这可能需要数年时间才能发展,但这是感染 HPV 的最重要结果之一。新加坡的 HPV 感染有多普遍?我该如何保护自己免受 HPV 感染?据估计,每 10 人中就有 8 人在一生中的某个时刻会感染 HPV。[来源:SCS] 降低 HPV 感染风险的最佳方法是接种疫苗。新加坡批准使用的 HPV 疫苗有哪些?新加坡批准使用的 HPV 疫苗是 Cervarix 和 Gardasil 9。HPV 疫苗接种可预防可能导致宫颈癌的特定类型的 HPV 感染。Cervarix 可预防 70% 的宫颈癌。Gardasil 9 可预防 90% 的宫颈癌。它还可预防非致癌性 HPV 感染菌株(例如生殖器疣)。UHC 提供哪种 HPV 疫苗?UHC 提供 Gardasil 9 疫苗。这是一个 3 剂的疗程,需在 6 个月内完成。建议的接种时间表为0、2和6个月,即第一剂和第二剂之间间隔2个月,第二剂和第三剂之间间隔4个月。
使用Aptima mRNA高危人乳头瘤病毒(...
摘要 目的 评估在初级 HPV 宫颈筛查计划中使用 Aptima 信使 RNA (mRNA) 高危人乳头瘤病毒 (HR-HPV) 检测与 DNA HR-HPV 检测的影响。设计 通过 HPV 初级宫颈筛查跟踪一个假设队列 3 年。背景 英格兰。参与者 一个假设的 25-65 岁女性队列,在国家医疗服务体系 (NHS) 宫颈筛查计划 (CSP) 中接受首次呼叫或常规召回检测。方法 使用来自 CSP (2017/18) 和 HORIZON 研究的数据参数化的决策树。使用来自 FOCAL 和 GAST 研究的数据、其他 DNA HPV 测试以及单向和概率敏感性和情景分析进行不确定性分析,以检验结果的稳健性。干预措施 Aptima mRNA HR-HPV 检测和 DNA HR-HPV 检测(cobas 4800 HPV 检测)。主要结果指标主要:该群体的阴道镜检查总数和总费用。次要:HPV 和细胞学检查总数、失访人数。结果在基线时,对于 225 万女性人群,如果使用 Aptima mRNA 检测代替 DNA 检测,估计可以节省 1,540 万英镑(95% 可信区间 (CI) 650 万至 2,410 万英镑)并避免 28,009 例(95% CI 27,499 至 28,527)不必要的阴道镜检查,减少 90,605 例不必要的 HR-HPV 检查和 253,477 例细胞学检查。这些节省是由于 mRNA 组中 HPV 阳性样本数量较少。当与其他主要 HPV 筛查试验的数据进行比较时,结果表明使用 Aptima mRNA 检测在每种情况下都可以节省成本并减少检测。结论 与 DNA 检测相比,使用 Aptima mRNA 检测几乎肯定会节省成本并减少不必要的测试和程序,从而使 NHS 和 CSP 中的女性受益。
缓解人乳头瘤病毒疫苗犹豫
来自华盛顿座位的弗雷德·哈钦森癌症研究中心公共卫生科学学院哈钦森癌症研究所1研究所。 2北卡罗莱纳州教堂山的北卡罗来纳大学全球公共卫生学院健康行为系,北卡罗来纳州教堂山; 3宾夕法尼亚州宾夕法尼亚州宾夕法尼亚州医学院公共卫生科学系; 4宾夕法尼亚州宾夕法尼亚州宾夕法尼亚州宾夕法尼亚州医学中心的宾夕法尼亚州立癌症研究所; 5 UNC Lineberger综合癌症中心,北卡罗来纳大学北卡罗来纳州教堂山的北卡罗来纳大学; 6公共卫生领导计划,UNC Gillings全球公共卫生学院,北卡罗来纳州教堂山教堂山的北卡罗来纳州大学的大学;和7 Safechild倡导中心,北卡罗来纳州罗利的Safechild倡导中心地址:Parth D. Shah,Pharmd,Pharmd,博士,Hutchinson癌症成果研究所,公共卫生科学司,Fred Hutchinson Cancer Research Center,Fairview Avenue North 1100电子邮件:pshah@fredhutch.org。 0749-3797/$ 36.00 https://doi.org/10.1016/j.amepre.2021.02.009电子邮件:pshah@fredhutch.org。0749-3797/$ 36.00 https://doi.org/10.1016/j.amepre.2021.02.009
预防性人乳头瘤病毒疫苗接种研究进展
宫颈癌是女性发病率最高的恶性肿瘤之一,据世界卫生组织(WHO)统计,全球每年新增宫颈癌病例57万,死亡31.3万(1)。19世纪80年代,德国科学家Zur等发现人乳头瘤病毒(HPV)感染与宫颈癌有关(2)。预防性HPV疫苗在降低HPV感染率方面发挥着重要作用,是预防HPV相关疾病特别是宫颈癌的革命性一步。自2006年以来,预防性HPV疫苗已在100多个国家获得许可(3)。目前有三种类型(表1):Cervarix(葛兰素史克生物制品公司,比利时)、Gardasil(默克公司,美国)和Gardasil9(默克公司,美国)(4)。 Cervarix 是一种二价 HPV (2vHPV) 疫苗,含有两种病毒样颗粒 (VLP),包括 HPV 16 和 18 VLP,70% 的宫颈恶性肿瘤由此引发 ( 5 )。Gardasil 是一种四价 HPV (4vHPV) 疫苗,含有 HPV 16 和 18 VLP 以及 6 型和 11 型 VLP,与 90% 的生殖器疣感染有关 ( 6 )。Gardasil 9 是一种九价 HPV (9vHPV) 疫苗,适用于 HPV 6/11/16/18/31/33/45/52/58。2007 年,4vHPV 和 2vHPV 获得许可(图 1)。2014 年,9vHPV 获得许可 ( 7 )。目前已确定接种疫苗可降低女性和男性生殖道疾病的发病率,包括肛门和口腔HPV感染以及宫颈、阴道、外阴、阴茎和肛门上皮内瘤变(4)。自获得许可以来,全球范围内HPV感染率和发病率已大幅下降。预防性HPV疫苗的安全性、有效性和持续时间已得到WHO的确认,这使得通过接种疫苗控制人类HPV相关宫颈癌的发生成为可能。本文综述了3种HPV疫苗的最新进展以及有前景的疫苗,为HPV疫苗的进一步应用提供理论基础。HPV是一种嗜上皮病毒,属于乳头瘤病毒科,具有多种动物和人类宿主(8)。根据HPV引起病变的能力,HPV可分为