XiaoMi-AI文件搜索系统
World File Search System分层图表示学习用于预测药物-靶标结合亲和力
由于与二元相互作用预测相比,药物-靶标结合亲和力 (DTA) 的识别具有更具体的解释能力,因此在药物发现过程中引起了越来越多的关注。最近,由于其令人满意的性能,许多基于深度学习的计算方法来预测药物和靶标之间的结合亲和力。然而,之前的工作主要集中于编码药物和靶标的生物学特征和化学结构,缺乏从药物-靶标亲和力网络中挖掘必要的拓扑信息。在本文中,我们提出了一种用于药物-靶标结合亲和力预测的新型分层图表示学习模型,即 HGRL-DTA。我们模型的主要贡献是建立一个分层图学习架构,以结合药物/靶标分子的固有属性和药物-靶标对的拓扑亲和力。在这个架构中,我们采用了一种消息广播机制来整合从全局级亲和图和局部级分子图中学习到的层次化表示。此外,我们设计了一个基于相似性的嵌入图来解决推断未见药物和靶标表示的冷启动问题。不同场景下的综合实验结果表明,HGRL-DTA 明显优于最先进的模型,并且在所有场景中都表现出更好的模型泛化能力。
评估终点方法预测蛋白激酶抑制剂的结合亲和力趋势的能力
蛋白激酶(PK)酶是巨大的超家族的一部分,在各种细胞活化事件中起着重要作用。1 PK酶会催化磷酸基团在酶(苏氨酸,丝氨酸,酪氨酸和组氨酸)中存在于酶的催化位点(也称为ATP结合位点)中,这代表了调节酶活性的关键过程。PK酶的三维结构是由两个域(也称为Lobes)形成的,它们通过固定铰链区域相互关联。这两个结构域之间的界面形成了疏水性CLE构造ATP结合位点(图1)。较小的N端子结构域由B-表格(B 1 - B 5)和一个螺旋(称为C)构成,而第二个C末端域则由多个A螺栓(A D - A I)富集。2 - 4 PK酶共享一些2 - 4 PK酶共享一些
机械 QSAR 分析预测不同杂环化合物作为选择性美人蕉的结合亲和力
a 印度阿姆劳蒂 Mardi 路 Rajendra Gode 药学院药物化学系;b 沙特阿拉伯利雅得伊玛目穆罕默德伊本沙特伊斯兰大学理学院化学系;c 沙特阿拉伯莫哈伊尔阿西尔哈立德国王大学科学与艺术学院化学系;d 马来西亚双威城双威大学医学与生命科学学院;e 伊拉克埃尔比勒 Tishk 国际大学药学院药物化学系;f 沙特阿拉伯阿尔哈吉 Prince Sattam Bin Abdulaziz 大学药学院药理学与毒理学系;g 印度兰契 Birla 理工学院药物科学与技术系;h 沙特阿拉伯利雅得 AlMaarefa 大学医学院基础医学系
用低亲和力荧光指示剂测量神经元钙和钠信号的空间和时间方面
HAL 是一个多学科开放存取档案库,用于存放和传播科学研究文献,无论这些文献是否已出版。这些文献可能来自法国或国外的教学和研究机构,也可能来自公共或私人研究中心。
药物靶标突变导致蛋白质-药物结合亲和力变化的计算研究
以及合成抗菌剂。尽管大多数感染仍可通过小分子药物治疗,但耐多药菌株已变得越来越普遍,对人类和动物的健康和福祉构成了严重威胁。许多其他病原体,如病毒、真菌和单细胞寄生虫,已对现有的药物库产生了部分或完全耐药性。靶向癌症疗法也面临同样的问题。这些药物的目的是通过靶向肿瘤特有的细胞生长和增殖机制来抑制肿瘤的生长;此类药物通常在治疗开始时效果很好,但肿瘤细胞逐渐对治疗产生耐药性。对抗癌化疗的耐药性也很常见。病毒、癌细胞和微生物对治疗产生耐药性的最普遍机制之一是作为分子药物靶标的蛋白质发生突变。3 氨基酸残基的单一替换就足以导致耐药性。认识到耐药性迟早会出现,我们需要开发出更好的治疗方案来避免耐药性。联合疗法在疗效和降低耐药性风险方面通常比单一药物表现更好,但也可能导致额外的副作用,并增加多种药物的毒性和药物间相互作用的风险。此外,一旦联合疗法因耐药性而失败,其他疗法的可用性就会受到限制。因此,迫切需要开发更适合对抗耐药性突变的新疗法。开发克服耐药性突变的新药需要了解导致耐药性的因素。在某些情况下,检查药物结合分子靶标的晶体结构就足以设想突变如何导致耐药性。然而,在许多情况下,情况更加复杂,因为突变残基并不位于药物附近,而且不清楚为什么会选择突变并导致耐药性。要充分解释突变对耐药性的影响,需要了解靶蛋白的动力学及其如何与药物结合。基于模拟的方法已经达到了足够准确的程度,可以深入了解此类过程并提供有关耐药性的线索。4 在某些情况下,这种模拟足以充分解释药物结合热力学的变化。在其他情况下,需要结合结构、生物物理和计算研究的数据。本文的目的是对用于此目的的方法进行概述。在从进化的角度简要介绍抗性突变后,详细讨论了结合亲和力(描述了用于估计这些亲和力的实验和模拟方法)。准确估计突变后的结合亲和力变化将大大提高我们设计更好药物的能力。不幸的是,这在许多情况下并不简单,在调查可用的计算方法后,本文详细讨论了当前的限制以及绊脚石。最后,介绍了一些使用模拟来更好地理解耐药性的案例研究。为了完整起见,在结论部分之前简要讨论了可能导致耐药性的其他因素。
FlowDock:生成蛋白质配体对接和亲和力预测的几何流量匹配
最近已经提出了动机的强大生成模型,但这些方法中很少有支持柔性蛋白质配体对接和亲和力估计。没有人可以直接对多种结合配体进行同时建模,也可以根据药理学相关的药物靶标进行严格的标准,从而阻碍了它们在药物发现工作中的广泛采用。 导致这项工作,我们提出了FlowDock,这是一种基于条件流量匹配的深几何生成模型,该模型学会了将其直接映射到其绑定的(Holo)对应物中,以将其映射到任意数量的结合配体中。 此外,Flowdock与其每种生成的蛋白质配体复杂结构中提供了预测的结构置信度评分和结合亲和力值,从而实现了新(多配体)药物目标的快速虚拟筛选。 对于常用的PoseBusters基准数据集,Flotdock使用Unbound(APO)蛋白质输入结构实现了51%的盲区对接成功率,而没有任何来自多个序列比对的信息,并且对于具有挑战性的新Dockgen-E数据集,FlotDock与单次序列Chai-1的性能相匹配。 此外,在第16个社区范围内的结构预测技术批判性评估(CASP16)的配体类别中,Flowdock在140种蛋白质配体复合物中的药理学结合亲和力估计的前5位方法中排名,证明了其在虚拟筛选中的学位表达的功效。没有人可以直接对多种结合配体进行同时建模,也可以根据药理学相关的药物靶标进行严格的标准,从而阻碍了它们在药物发现工作中的广泛采用。导致这项工作,我们提出了FlowDock,这是一种基于条件流量匹配的深几何生成模型,该模型学会了将其直接映射到其绑定的(Holo)对应物中,以将其映射到任意数量的结合配体中。此外,Flowdock与其每种生成的蛋白质配体复杂结构中提供了预测的结构置信度评分和结合亲和力值,从而实现了新(多配体)药物目标的快速虚拟筛选。对于常用的PoseBusters基准数据集,Flotdock使用Unbound(APO)蛋白质输入结构实现了51%的盲区对接成功率,而没有任何来自多个序列比对的信息,并且对于具有挑战性的新Dockgen-E数据集,FlotDock与单次序列Chai-1的性能相匹配。此外,在第16个社区范围内的结构预测技术批判性评估(CASP16)的配体类别中,Flowdock在140种蛋白质配体复合物中的药理学结合亲和力估计的前5位方法中排名,证明了其在虚拟筛选中的学位表达的功效。可用性和实现源代码,数据和预训练的模型可在https://github.com/ bioinfaramefaraminelearning/flowdock上找到。
亲和力小组电子书:受监管的大麻行业的兴起和曼岛优势
法律挑战:大麻部门面临的最重要的障碍之一是复杂且通常不一致的法律格局。在国家和国际层面存在监管障碍,为企业驾驶的挑战性迷宫。跨国立法的差异可能会使事情进一步复杂化。例如,尽管加拿大这样的国家已经完全合法化了大麻,但它仍然严格控制着许多国家。这种差异为希望跨境扩展的企业造成了不确定性,要求他们理解并遵守不同的法规,这通常是令人生畏的和资源密集的。
用于计算分子激发能,电离电位和电子亲和力的量子自符合方程式方法
用于估计嘈杂的中间量子量子(NISQ)ERA设备上的分子基态性能,基于变异的量子本特征(VQE)算法的算法已获得流行,因为它们相对较低的电路深度和对噪声的弹性。9,10这导致了一系列成功的演示,涉及当今量子设备和模拟器上小分子的分子基态能量的计算。4,6,11 - 22然而,仅对分子基态能量的估计不足以描述许多有趣的化学过程,这些化学过程涉及某种形式的电子激发。23,例如,化学现象的准确建模,例如光化学反应,涉及过渡金属复合物,光合作用,太阳能电池操作等的催化过程等。需要对分子地面和激发态进行精确模拟。这种系统的电子激发态通常密切相关,因此需要使用复杂的量子化学理论来准确描述。在过去的几十年中,在这方面已经开发了许多方法。24 - 32最初由Stanton和Bartlett开发的运动方程耦合群集(EOM-CC)26方法是一个流行的示例,通常用于计算分子激发剂,例如激发能量
用于计算分子激发能,电离电位和电子亲和力的量子自符合方程式方法
用于估计嘈杂的中间量子量子(NISQ)ERA设备上的分子基态性能,基于变异的量子本特征(VQE)算法的算法已获得流行,因为它们相对较低的电路深度和对噪声的弹性。9,10这导致了一系列成功的演示,涉及当今量子设备和模拟器上小分子的分子基态能量的计算。4,6,11 - 22然而,仅对分子基态能量的估计不足以描述许多有趣的化学过程,这些化学过程涉及某种形式的电子激发。23,例如,化学现象的准确建模,例如光化学反应,涉及过渡金属复合物,光合作用,太阳能电池操作等的催化过程等。需要对分子地面和激发态进行精确模拟。这种系统的电子激发态通常密切相关,因此需要使用复杂的量子化学理论来准确描述。在过去的几十年中,在这方面已经开发了许多方法。24 - 32最初由Stanton和Bartlett开发的运动方程耦合群集(EOM-CC)26方法是一个流行的示例,通常用于计算分子激发剂,例如激发能量
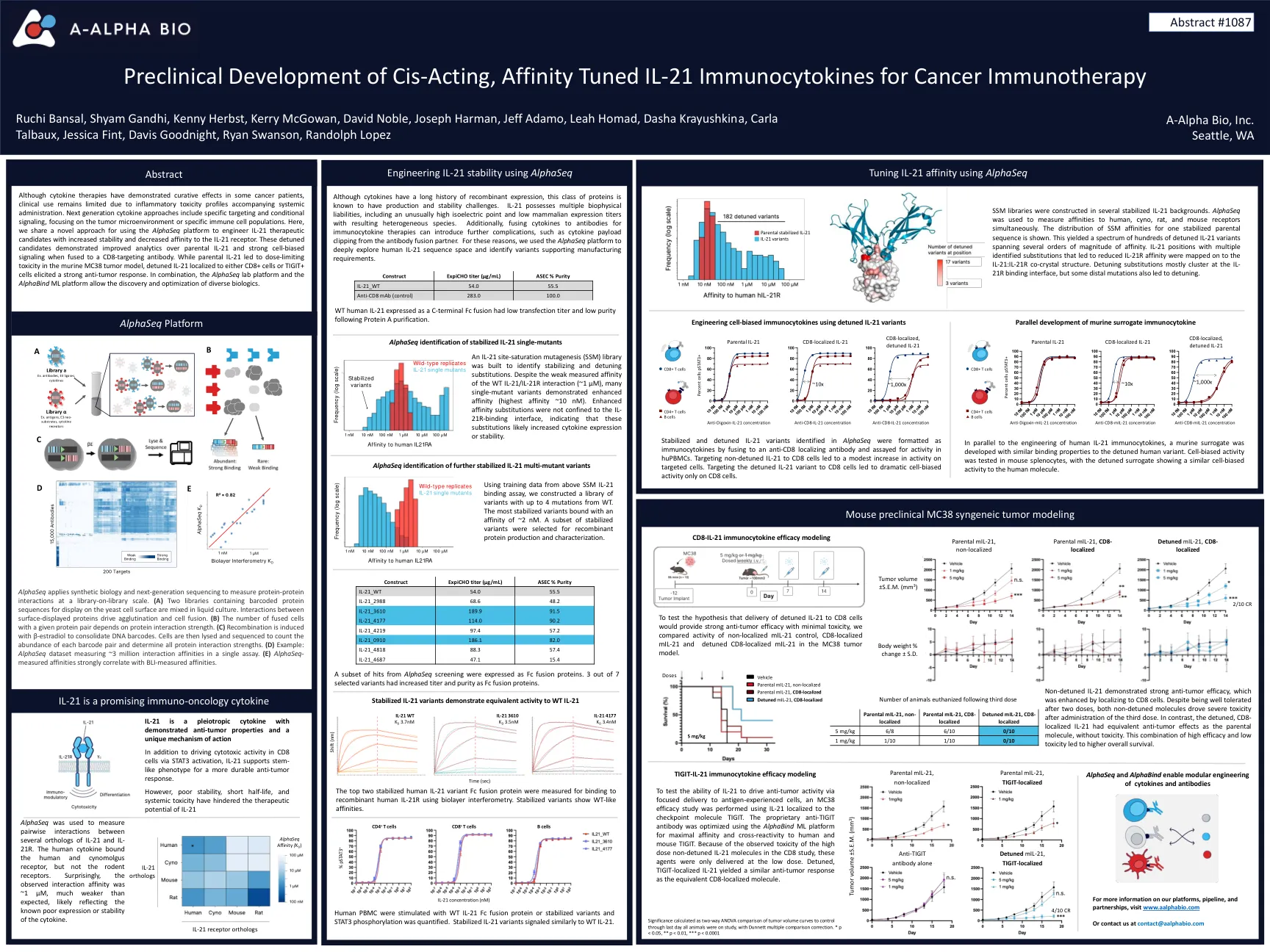
顺式作用,亲和力调节IL-21免疫细胞免疫疗法的免疫细胞因子
尽管细胞因子疗法在某些癌症患者中表现出治愈作用,但由于伴随全身给药的炎症毒性特征,临床用途仍然有限。下一代细胞因子方法包括特定的靶向和条件信号传导,重点是肿瘤微环境或特定的免疫细胞群体。在这里,我们共享一种新的方法,用于使用Alphaseq平台来设计IL-21治疗候选者,具有提高稳定性并降低对IL-21受体的亲和力。当与CD8靶向抗体融合时,这些失调的候选者对亲本IL-21和强细胞偏置信号传导的分析有所改善。虽然父母IL-21导致鼠MC38肿瘤模型中的剂量限制性毒性,但局部局部在CD8+细胞或Tigit+细胞的IL-21引起了强烈的抗肿瘤反应。结合使用,Alphaseq Lab Platform和Alphabind ML平台允许发现和优化各种生物制剂。