XiaoMi-AI文件搜索系统
World File Search System出血疾病的进步2024 ASH经典血液学亮点
开放标签,单臂,第2期临床试验成人获得的成年血友病A先前未接受免疫抑制(n = 47)患者皮下接受emicizumab(在第1和第1和第2周的第1和第2天,每周为6和3 mg/kg),直到第12周,但没有免疫抑制。随访时间为24周。主要终点是每周临床相关的出血数量,直到第12周。emicizumab被认为有效,这是在研究和免疫抑制中观察到的倾向评分匹配的速率(n = 101)。
MMR疫苗接种的推荐形式
建议接受免疫抑制治疗的疫苗。COVID-19,请参阅第4部分 - 生物产品,COVID-19疫苗,以获取建议和免疫抑制疗法以及与COVID-19疫苗接种的时间。肺炎球菌疫苗结合物和/或多糖疫苗取决于年龄。只需要一次使用多糖疫苗重新接种。HIB疫苗未免疫的个体5岁及以上需要1剂。流感疫苗每年免疫(所有6个月及以上)。应使用灭活的流感疫苗。 禁忌 MMR疫苗(除非存在野生型感染的重大风险,并且客户仅接受低剂量的免疫抑制药物)。 是指灭活和活疫苗的免疫。 使用推荐形式进行MMR疫苗接种。 节禁忌疫苗(除非存在野生型感染的重大风险,并且服务对象仅接受低剂量的免疫抑制药物)。 是指灭活和活疫苗的免疫。 使用推荐形式进行水痘疫苗接种。 轮状病毒疫苗是指灭活和活疫苗的免疫。 使用转介形式进行轮状病毒疫苗。 长期免疫抑制疗法包括但不限于:应使用灭活的流感疫苗。MMR疫苗(除非存在野生型感染的重大风险,并且客户仅接受低剂量的免疫抑制药物)。是指灭活和活疫苗的免疫。使用推荐形式进行MMR疫苗接种。节禁忌疫苗(除非存在野生型感染的重大风险,并且服务对象仅接受低剂量的免疫抑制药物)。是指灭活和活疫苗的免疫。使用推荐形式进行水痘疫苗接种。轮状病毒疫苗是指灭活和活疫苗的免疫。使用转介形式进行轮状病毒疫苗。长期免疫抑制疗法包括但不限于:
安大略省科学咨询表药物和生物制剂临床实践指南工作组、安大略省科学咨询表集中护理工作组
1. 免疫功能低下或免疫抑制个体的例子包括接受实体肿瘤和血液系统恶性肿瘤治疗(包括正在接受监测但未接受积极治疗的淋巴系统恶性肿瘤个体)、接受实体器官移植并接受免疫抑制治疗、接受嵌合抗原受体(CAR)-T 细胞或造血干细胞移植(移植后 2 年内或接受免疫抑制治疗)、中度或重度原发性免疫缺陷(例如 DiGeorge 综合征、Wiskott-Aldrich 综合征、常见变异性免疫缺陷、Good 综合征、高 IgE 综合征)、晚期或未经治疗的 HIV 感染、使用大剂量皮质类固醇积极治疗(即每天服用≥20 mg 泼尼松或等效药物,连续服用≥2 周)、烷化剂、抗代谢物、移植相关的免疫抑制药物、被归类为重度免疫抑制的癌症化疗药物、肿瘤坏死因子(TNF) 阻滞剂和其他具有免疫抑制或免疫调节作用的生物制剂。2. 年龄较低人群可接受的住院风险至少为 1-2%。
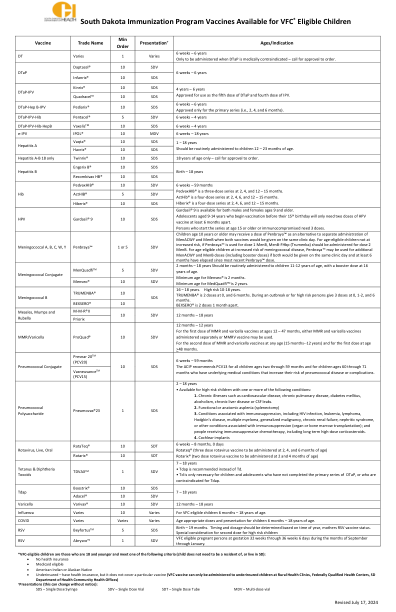
南达科他州免疫计划疫苗可供 VFC * 符合条件的儿童使用
1. 心血管疾病、慢性肺部疾病、糖尿病、酒精中毒、慢性肝病或脑脊液漏等慢性疾病。2. 功能性或解剖性无脾(脾切除术)3. 与免疫抑制有关的疾病,包括 HIV 感染、白血病、淋巴瘤、霍奇金病、多发性骨髓瘤、全身恶性肿瘤、慢性肾衰竭、肾病综合征或其他与免疫抑制有关的疾病(器官或骨髓移植);以及接受免疫抑制化疗的人,包括长期使用大剂量皮质类固醇。4. 人工耳蜗
ID训练营:固体器官和干细胞移植扬声器
•主动治疗实体瘤和血液系统恶性肿瘤•接受固体器官移植并接受免疫抑制治疗•接收CAR -T -CELL或造血干细胞移植(在2年内移植或接受免疫抑制治疗)•中度或严重的原发性免疫缺陷(E.G.G.G.G.G.G.G.G.,W中)或未经处理的HIV感染•与:•高剂量皮质类固醇(即≥20mg泼尼松或每天≥20mg泼尼松或等效的每天)•烷基化剂,抗超代谢物•抗体相关的免疫治疗药物•被分类为严重的免疫治疗剂•严重的免疫治疗剂•Tumorsical•Tumorsic•Tumors -necristical•Tumors -nnfecristial -tamecristical -tamecrsis(Tumors)(Tumors)(Tumors)。免疫抑制或免疫调节。在评估患者中免疫能力的一般水平时要考虑的因素包括疾病的严重程度,持续时间,临床稳定性,并发症,合并症以及任何潜在的免疫抑制治疗。
南达科他州免疫计划疫苗可供 VFC * 符合条件的儿童使用
1. 心血管疾病、慢性肺部疾病、糖尿病、酒精中毒、慢性肝病或脑脊液漏等慢性疾病。2. 功能性或解剖性无脾(脾切除术)3. 与免疫抑制有关的疾病,包括 HIV 感染、白血病、淋巴瘤、霍奇金病、多发性骨髓瘤、全身恶性肿瘤、慢性肾衰竭、肾病综合征或其他与免疫抑制有关的疾病(器官或骨髓移植);以及接受免疫抑制化疗的人,包括长期使用大剂量皮质类固醇。4. 人工耳蜗
对创新免疫治疗策略的影响
胰腺癌,特别是胰腺导管腺癌 (PDAC),是美国第四大癌症相关死亡原因,其特点是治疗困难且预后不佳。随着免疫疗法成为减轻 PDAC 恶性进展的一种有希望的途径,全面了解肿瘤的免疫抑制特性变得势在必行。本文系统地探讨了 PDAC 内复杂的免疫抑制网络,重点介绍了免疫抑制细胞与缺氧酸性胰腺肿瘤微环境中的因素之间的显著串扰。通过阐明这些机制,我们旨在为潜在的免疫治疗策略和治疗目标提供见解,为未来对 PDAC 免疫抑制的研究奠定基础。认识到免疫抑制对 PDAC 侵袭和转移的深远影响,本次讨论旨在催化为 PDAC 患者开发更有效、更有针对性的免疫疗法。
肾脏移植后共享护理模型
•应与其他护理提供者进行的免疫抑制以外的其他药物治疗方案的变化进行讨论或至少与移植中心进行通信,因为其他药物可能会大大干扰免疫抑制药物。这特别适用于影响CYP3A4代谢的药物。
疫苗接种和 SNI SORARE lastToulouse
• 与治疗/SNI 发作相关的感染风险 • 疫苗可能无效(在发作期间或接受免疫抑制治疗期间接种疫苗) • 接受免疫抑制治疗的患者存在“疫苗疾病”风险 • 存在引发 SNI 复发的风险
更新:患者问答:通过安大略省药房接种 COVID-19 疫苗
• 接受实体瘤或血液系统恶性肿瘤积极治疗(如化疗、靶向治疗、免疫治疗)的患者 • 接受实体器官移植并接受免疫抑制治疗的患者 • 接受嵌合抗原受体 (CAR)-T 细胞治疗或造血干细胞移植的患者(移植后 2 年内或接受免疫抑制治疗)。 • 患有中度至重度原发性免疫缺陷的患者(如 DiGeorge 综合征、Wiskott-Aldrich 综合征)。 • 感染 HIV 且既往患有艾滋病或既往 CD4 计数 ≤ 200/mm3 或既往 CD4 分数 ≤ 15% 或(5-11 岁儿童)围产期获得性 HIV 感染的个人 • 接受以下类别免疫抑制疗法积极治疗的个人:抗 B 细胞疗法 3(针对 CD19、CD20 和 CD22 的单克隆抗体)、高剂量全身皮质类固醇(有关高剂量类固醇的建议定义请参阅加拿大免疫指南)、烷化剂、抗代谢物或肿瘤坏死因子 (TNF) 抑制剂和其他具有显着免疫抑制作用的生物制剂。