XiaoMi-AI文件搜索系统
World File Search System通过 CRISPR 协调玉米基因上调
基因组编辑技术显著提高了我们精确修改基因组和基因的能力,为设计内源途径和性状开辟了新的可能性。在玉米等作物中,已经证实可以实现小的插入/缺失、碱基变化和结构变异(Nuccio 等人,2021 年)。然而,虽然这些编辑通常会导致基因敲除 (KO) 或敲低,但许多农艺性状的改善需要更高的基因表达,有益的天然等位基因和转基因就是明证。因此,作物改良需要能够可预测和可调整地上调多个基因的工具,而没有使用转基因的技术限制和监管弊端。为了开发一种广泛适用的通过编辑增加基因表达的方法,我们寻找了一种玉米原生的小元素,可以将其插入内源启动子中以实现上调。我们在玉米基因组中发现了一个回文 12 bp 序列 GTAAGCGCTTAC(“植物增强子”,PE),它与农杆菌章鱼碱合酶启动子中已知的转录增强子元件(Bouchez 等人,1989)相似,并且也出现在其他作物(如大豆、水稻和大麦)的基因组中。为了在非同源末端连接 (NHEJ) 介导的 CRISPR/Cas 诱导的双链断裂修复过程中将 PE 插入玉米启动子中(图 1a),我们用金粒子轰击了来自 Cas9 表达系的未成熟玉米胚 (Lorenzo 等人,2022),这些金粒子包裹着 (i) 针对谷氨酰胺合成酶 1-3 (Gln1-3) 核心启动子的合成单向导 RNA (sgRNA),(ii) PE 三聚体 (3xPE) 作为双链寡脱氧核苷酸 (dsODN),两端有两个保护性硫代磷酸酯键,没有任何目标同源序列,和 (iii) 携带除草剂抗性标记和荧光蛋白的表达盒的质粒,允许在再生过程中进行选择和视觉筛选。39% 的再生系在目标启动子中携带 dsODN 衍生的插入。除了完美的 3xPE 插入,由于 NHEJ 的不精确性,我们还恢复了连接处有小插入/缺失的等位基因、截断处只留下一个或两个 PE 单体或插入一个以上 3xPE 元件的等位基因(图 1b)。插入等位基因通常存在于 50% 或 100% 的扩增子测序读数中,
ErCas12a CRISPR-MAD7 用于人类细胞、小鼠和大鼠的模型生成
摘要 MAD7 是从直肠真杆菌中分离出来的一种工程化的 2 类 VA 型 CRISPR-Cas (Cas12a/Cpf1) 系统。与 Cas9 类似,它是一种 RNA 引导的核酸酶,在大肠杆菌和酵母细胞中具有基因编辑活性。本文报告称,MAD7 能够分别在人类 HCT116 和 U2OS 癌细胞系中产生内源基因的插入/缺失和荧光基因标记。此外,MAD7 非常擅长在小鼠和大鼠胚胎中产生插入/缺失、小 DNA 插入(23 个碱基)和 1 至 14 kb 大小的较大整合,从而产生活产转基因动物。由于不同的原间隔区相邻基序要求、小引导 RNA 和高效的靶向基因破坏和插入,MAD7 可以扩展 CRISPR 工具箱,用于跨不同系统和模型生物进行基因组工程。
生成基因工程动物模型的新方法
转基因依赖于使用大型复杂的表达载体,在病毒或组织特异性哺乳动物启动子的控制下,通过显微注射将载体递送到原核阶段受精卵中,从而指导互补 DNA (cDNA) 的表达(图 1)。虽然这种方法提供了一种粗略但有效的方法来设计表达报告基因、基因突变形式和条件调控基因的动物模型,但它不能用于精确修改内源基因。此外,转基因在小鼠基因组内的整合是随机发生的,整合位点的位置以及整合的次数可能会影响转基因的表达。此外,如果转基因整合破坏了基因或转录调控元件,整合位点本身可能会诱导其自身的表型。由于转基因整合位点和转基因整合次数可能因小鼠而异,因此需要扩展多个创始者并检查转基因表达水平和由此产生的表型 [1]。
纳米球-AccessData.fda.gov
i在生物学或实验相关的浓度下,通过BC-GN检测对不同血液培养基中存在的INL患者血液样本和血液培养瓶添加剂的潜在抑制作用进行了测试。研究的设计考虑到BC-GN测试样品制备过程固有地起作用,以最大程度地减少血液中存在的干扰的潜力。样本会影响测试。在存在几种内源物质的情况下,用八(8)(8)(8)(8)(8)bc-gn测试细菌靶标和六(6)个电阻标记物的一个代表性应变评估了潜在干扰物质的影响。H-恒星蛋白,甘油三酸酯,共轭和未结合的胆红素。Y-固醇和硫酸钠硫酸盐(SP)进行测试。还测试了未包含干扰物的对照样品。未观察到干扰效应。
评估经济健康 - Gertjan的演讲...
注释:对于所有列,因变量是从2019年第4季度到2020 Q2的真实GDP的变化。样本包括53个国家,在估算时,在重新定位数据流中可以使用Q2 GDP增长。通过牛津严格指数的平均值来衡量每个国家/地区非药物干预措施(NPI)的实施(Hale等人2020)在本季度;爆发严重性变量COVID表示在季度内每100万流行中的新Covid-19死亡人数,如Refinitiv DataStream所报道。对于仪器变量(IV)规格,该仪器集包括所有内源变量的滞后以及该国联合国M49 M49中间区域内的爆发严重程度,但不包括其自身爆发。IV2规范还增加了该地区内的平均严格性(不包括自己的),直到该国首次将每百万人为3人死亡的天数与仪器组合。
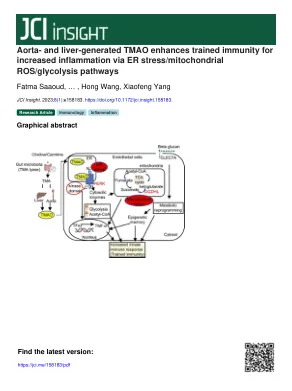
主动脉和肝脏生成的TMAO增强了受过训练的免疫力,可通过ER应力/线粒体ROS/糖酵解途径增加炎症
引言血管炎症对动脉粥样硬化的发作和并发症显着促进(1-5)。canakinumab抗炎血栓形成结果研究(CANTOS)表明,促炎性IL-1β的抑制可减轻心血管疾病(CVD)中的动脉粥样硬化负担(6)。我们提出了以下概念:(a)内皮细胞(EC)是先天免疫细胞(3-5,7-12); (b)激活的EC的特征是与危险相关的分子模式(潮湿)受体和主要的组织相容性复合物(MHC)分子(13)的上调,此外还增加了粘附分子和细胞因子/趋化因子/趋化因子的上调; (c)与其内在受体结合而非经典湿受体(例如TLR)结合的内源代谢产物可能会变成条件潮湿(14-17); (d)EC具有先天的免疫记忆功能(受过训练的免疫[TI])(2,3,18-20)。然而,如何有条件的潮湿(例如肠道微生物群产生的尿毒症毒素(UT)(21,22)三甲胺N-氧化物(TMAO)促进人主动脉ECS(HAEC)中的Ti仍然很差。
胆管癌中循环肿瘤DNA的基因分型揭示
上皮免疫反应控制组织稳态,并提供针对不适的药物靶标。在这里,我们报告了一个生成药物发现的框架 - 对病毒感染的细胞反应的现成记者。我们反向工程上皮细胞对SARS-COV-2的反应,SARS-COV-2,这种病毒剂为正在进行的Covid-19 pan-panemic燃料,并设计了合成转录报告基因,其分子逻辑包含干扰素-α/β/β/γ/γ/γ和NF-κB途径。这种调节势反映了从实验模型到严重的Covid-19患者上皮细胞感染的单细胞数据。SARS-COV-2,I型干扰素和RIG-I Drive Reporter Activation。实时细胞图像 - 基于表型药物筛选确定了JAK抑制剂和DNA损伤诱导剂是对干扰素,RIG-I刺激和SARS-COV-2的上皮细胞反应的拮抗调节剂。通过药物对记者的协同或拮抗剂调制,强调了其对内源转录程序的作用机理和收敛性。我们的研究描述了一种剖析对感染和无菌提示的抗病毒反应的工具,并迅速发现了有关新兴病毒的合理药物组合。
设计一种基因组减少的细菌来消除体内金黄色葡萄球菌生物膜
细菌为治疗人类疾病提供了一种很有前途的递送系统。在这里,我们设计了基因组减少的人类肺部病原体肺炎支原体作为活生物治疗剂来治疗生物膜相关细菌感染。该菌株具有独特的遗传密码,这会阻碍基因转移到大多数其他细菌属,并且它缺乏细胞壁,这使得它能够表达针对致病菌肽聚糖的蛋白质。我们首先确定去除致病因素可在体内完全减弱底盘菌株。然后,我们设计了合成启动子并确定了内源肽信号序列,当该序列与异源蛋白质融合时,可促进有效分泌。基于此,我们为底盘菌株配备了一个旨在分泌抗生物膜和杀菌酶的遗传平台,从而产生一种能够在体外、离体和体内溶解导管上预先形成的金黄色葡萄球菌生物膜的菌株。据我们所知,这是第一个可以对抗临床相关的生物膜相关细菌感染的工程基因组减少细菌。
与使用GLP-1激动剂和DPP-4抑制剂
胰高血糖素样肽-1(GLP-1)受体激动剂和二肽基肽酶-4(DPP-4)抑制剂(表1)是两种用于治疗2型糖尿病(T2DM)的新型药物类别。两个类别靶向肠降凝蛋白系统,并增加内源性激素GLP-1的作用,该激素GLP-1通过刺激胰岛素分泌,抑制胰高血糖素释放,减慢胃排空并促进饱腹感来调节血糖水平。尽管对T2DM的管理通常需要组合疗法,但美国食品药物管理局(FDA),美国糖尿病协会(ADA)和美国临床内分泌学协会(AACE)(AACE)还是建议同时使用GLP-1激动剂和DPP-4抑制剂,因为在这些型机构中不提供其他益处,因此不提供其他好处。1-3虽然并发治疗没有临床益处,但它可能会增加副作用的风险和与多药相关的其他负面结果。