XiaoMi-AI文件搜索系统
World File Search SystemHidrasec 10 毫克口服混悬剂颗粒
补液(包括呕吐和腹泻) Hidrasec 的给药不会改变通常的补液方案。补液在治疗婴儿急性腹泻方面非常重要。补液要求和途径应根据患者的年龄和体重以及病情的阶段和严重程度进行调整,特别是在严重或长期腹泻并伴有严重呕吐或食欲不振的情况下。如果出现严重或长期腹泻并伴有严重呕吐或食欲不振,应考虑静脉补液。血便或脓便和发烧可能表明腹泻是由侵入性细菌引起的,或者存在其他严重疾病。此外,消旋卡多曲尚未在抗生素相关性腹泻中进行过测试。因此,在这些情况下不应使用消旋卡多曲。
口服免疫疗法(OIT)用于治疗食物过敏口服免疫疗法(OIT)用于治疗食物过敏
•对同一食物过敏(疑似或已知)进行其他食物挑战测试的任何请求,都需要获得独立健康医疗总监的授权。提供者请求必须伴随着需要重复测试的临床指示的特定文档。Medicare Advantage:Medicare Advantage使用上述商业标准。Medisource,Medisource Connect,Child Health Plus和基本计划:根据纽约州的标准,对于那些对食物过敏或对口服药物过敏的患者来说,对口腔摄入挑战测试可能是医学上需要的,这是对临床症状尚无定论或不一致的。通常,口服摄入挑战测试不应用作过敏的一线测试。口腔摄入挑战测试仅应在精心监督的过敏专家环境中进行,并立即提供紧急支持。口腔摄入挑战测试是一项涵盖的服务,当认为在医学上确认阳性体内/体外测试结果或测试对以下方面的过敏反应的方法:
imkeldi(imatinib)口服解决方案-AccessData.fda.gov
•液体保留和水肿:水肿和严重的液体保留发生了。定期称重患者,并通过药物中断和利尿剂来管理意外的快速体重增加。(5.1,6.1)•血液学毒性:已经发生了细胞质,尤其是贫血,中性粒细胞减少症和血小板减少症。通过减少剂量,剂量中断或治疗中断进行管理。在第一个月进行每周的完整血液计数,每两周一次,此后定期进行。(5.2)•充血性心力衰竭和左心室功能障碍:严重的充血性心力衰竭和左心室功能障碍,特别是在合并症和危险因素的患者中。监测和治疗心脏疾病或心脏衰竭危险因素的患者。(5.3)•肝毒性:严重的肝毒性,包括死亡。在开始治疗前和每月或临床上的每月开始之前评估肝功能。监测肝功能与已知与肝功能障碍相关的化学疗法结合使用。(5.4)•出血:已在新诊断的CML和GIST患者的临床研究中报道了3/4级出血。GI肿瘤部位可能是GIST中GI出血的来源。(5.5)•胃肠道疾病:胃肠道(GI)穿孔,有些致命。(5.6)•嗜酸性心脏毒性:心脏源性休克/左心室功能障碍与具有高嗜酸性粒细胞水平相关的疾病(例如HES,MDS/MDS/MPD和ASM)的患者与Imkeldi的启动有关。(5.7)•皮肤病毒性:据报道,使用Imkeldi使用了大胆的皮肤病反应(例如,多形性红斑和史蒂文斯 - 约翰逊综合征)。(5.8)•甲状腺功能减退:甲状腺功能减退症的甲状腺功能减退症已在接受左甲状腺素替代的甲状腺切除术患者中。密切监测此类患者的TSH水平。(5.9)•胚胎毒性毒性:可能造成胎儿伤害。向胎儿潜在风险的生殖潜力建议女性,并使用有效的避孕。(5.10,8.1)•儿童和青少年的生长迟缓:据报道,接受Imkeldi的儿童和预科生发生的增长迟缓。建议在Imkeldi治疗下对儿童的生长进行密切监测。(5.11,6.2)•肿瘤裂解综合征:建议密闭监测。(5.12)•与驾驶和使用机械有关的障碍:接受伊马替尼的患者报告了机动车事故。注意驾驶汽车或操作机械的患者。(5.13)•肾脏毒性:接受imkeldi的患者可能发生肾功能下降。在基线和治疗过程中评估肾功能,并注意肾功能障碍的危险因素。(5.14)•测量设备:建议患者使用精确的毫升测量装置进行测量。通知患者,家茶匙不是准确的测量装置,可能导致过量,这可能导致严重的不良反应。(5.15)建议患者要求其药剂师建议使用适当的按入瓶适配器和口服注射器,以便用于测量正确剂量的说明。
Sotyktu(deucravacitinib)口服片年度审查日期
概述 Sotyktu 是一种酪氨酸激酶 2 (TYK2) 抑制剂,用于治疗适合全身治疗或光疗的成人中度至重度斑块状银屑病。使用限制:不建议将 Sotyktu 与强效免疫抑制剂联合使用。政策声明 本政策涉及 Sotyktu 的使用 建议事先授权 Sotyktu 的药房福利承保。建议对符合所提供诊断的标准和初步/扩大批准中承保条件的人进行批准。不建议批准的疾病按照建议的授权标准列出。对于本政策中未列出的用途的请求,将根据具体情况审查其疗效证据和医疗必要性。由于评估和诊断接受 Sotyktu 治疗的患者需要专业技能,并且需要监测不良事件和长期疗效,因此初步批准要求 Sotyktu 由专门研究所治疗疾病的医生开具处方或与其咨询。所有初始治疗的批准均在下述初始批准期限内提供;如果允许重新授权,则需要对治疗有反应才能继续治疗,除非下文另有说明。Sotyktu 受药房福利下的炎症状况护理价值计划的约束。推荐授权标准建议满足以下标准的人使用 Sotyktu:1. 斑块状银屑病。如果患者符合以下条件之一(A 或 B),则批准在下述期限内使用:
M13A:速释固体口服剂的生物等效性...
* M13A 中将对照品定义为“临床试验中用作参考的试验或上市产品,即活性对照品或安慰剂。在本指南中,对照品是监管机构接受的药品,申请人可以在进行 BE 研究时将其与测试产品进行比较。”
评论文章口服途径的Nioosomal药物
Aditya药房学院,BEED,MAHARASHTRA,印度摘要:Niosomes是具有潜在技术优势的人工囊泡。 它们是非离子表面活性剂囊泡。 作为具有广泛用途的有效药物递送系统,Niosomes具有与磷脂囊泡(脂质体)相同的潜在优势,包括容纳水和脂质的药物分子的能力。 Niosomes也可以被认为是更具成本效益,化学稳定且偶尔在物理上稳定的脂质体替代品。 可以采用简单的制备技术和药物技术中常用的表面活性剂来创建衰老。 许多研究涵盖了杂色的物理化学特征及其用作药物的使用。 本评论文章的重点是新俄罗斯的概念,优势和缺点,组成,制备方法,影响Niosomal配方和表征的因素,Niosomes的应用。 niosomes可以用于治疗多种疾病,例如牛皮癣,利什曼病,癌症,偏头痛,帕金森氏症等。 Niosomes可以用作诊断辅助。 Niosomal技术被广泛用于化妆品。 仍然,研究人员必须将很多重点放在药物输送中Niosomes的商业效用上。 关键字:Niosomes,表面活性剂,囊泡Aditya药房学院,BEED,MAHARASHTRA,印度摘要:Niosomes是具有潜在技术优势的人工囊泡。它们是非离子表面活性剂囊泡。作为具有广泛用途的有效药物递送系统,Niosomes具有与磷脂囊泡(脂质体)相同的潜在优势,包括容纳水和脂质的药物分子的能力。Niosomes也可以被认为是更具成本效益,化学稳定且偶尔在物理上稳定的脂质体替代品。可以采用简单的制备技术和药物技术中常用的表面活性剂来创建衰老。许多研究涵盖了杂色的物理化学特征及其用作药物的使用。本评论文章的重点是新俄罗斯的概念,优势和缺点,组成,制备方法,影响Niosomal配方和表征的因素,Niosomes的应用。niosomes可以用于治疗多种疾病,例如牛皮癣,利什曼病,癌症,偏头痛,帕金森氏症等。Niosomes可以用作诊断辅助。Niosomal技术被广泛用于化妆品。仍然,研究人员必须将很多重点放在药物输送中Niosomes的商业效用上。关键字:Niosomes,表面活性剂,囊泡
Imlunestrant,一种口服选择性雌激素受体降解剂
Komal L. Jhaveri 博士,医学博士,FACP 1,2; Elgene Lim 医学博士 3 ; Rinath Jeselsohn,医学博士 4; Cynthia X. Ma,医学博士 5 ; Erika P. Hamilton,医学博士 6;辛西娅·奥斯本,医学博士,7.8; Manali Bhave,医学博士 9 岁; Peter A.Kaufman,医学博士 10; J.Thaddeus Beck,医学博士 11; Luis Manso Sanchez,医学博士,12 岁; Ritesh Parajuli,医学博士 13; Hwei-Chung Wang,医学博士 14 ; Jessica J. Tao 医学博士 15; Seock-Ah Im,医学博士,16 岁;凯瑟琳·哈登(Kathleen Harnden),医学博士,17 岁; Kan Yonemori,医学博士 18 岁; Ajay Dhakal,医学博士,19 岁; Patrick Neven,医学博士,20 岁; Philippe Aftimos,医学博士,21 岁; Jean-Yves Pierga,医学博士,22 岁; Yen-Shen Lu,医学博士,23 岁;蒂莫西·拉森(Timothy Larson),医学博士,24 岁;尤兰达·杰雷斯 (Yolanda Jerez),医学博士,25 岁; Kostandinos Sideras, 医学博士,26 岁; Joohyuk Sohn,医学博士,27 岁; Sung-Bae Kim,医学博士,28 岁; Cristina Saura,医学博士,29 岁; Aditya Bardia,医学博士,30 岁; Sarah L.Sammons,医学博士 4,31;弗朗西斯卡·巴奇翁,MS 32;李宇佳,博士 32 ; Eunice Yuen 博士 32 ; Shawn T. Estrem,博士 32; Vanessa Rodrik-Outmezguine,博士 32 岁; Bastien Nguyen 博士 32 ; Roohi Ismail-Khan,医学博士,32 岁; Lillian Smyth,医学博士,32 岁;和 Muralidhar Beeram,医学博士 33
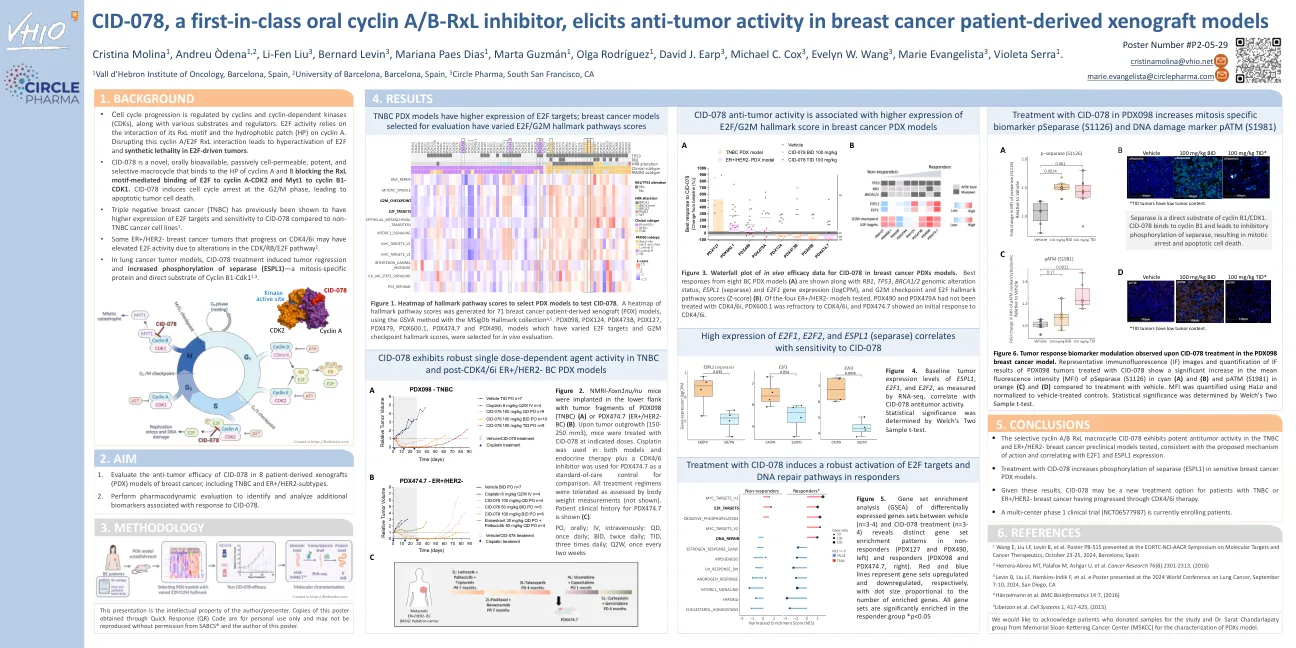
CID-078 是一种首创的口服细胞周期蛋白 A/B-RxL 抑制剂,可在乳腺癌患者异种移植模型中引发抗肿瘤活性
图 6. 在 PDX098 乳腺癌模型中,CID-078 治疗后观察到的肿瘤反应生物标志物调节。用 CID-078 治疗的 PDX098 肿瘤的代表性免疫荧光 (IF) 图像和 IF 结果的量化显示,与使用载体治疗相比,pSeparase (S1126)(青色)(A)和(B)以及 pATM (S1981)(橙色)(C)和(D)的平均荧光强度 (MFI) 显著增加。使用 HaLo 量化 MFI 并归一化为载体治疗的对照。通过 Welch 的双样本 t 检验确定统计显着性。
● Nuvisertib (TP-3654) 是一种口服高选择性 PIM1 激酶抑制剂,
马萨诸塞州马尔伯勒,2024 年 11 月 6 日 — 住友制药美国公司 (SMPA) 今天宣布,将在 2024 年 12 月 7 日至 10 日于加利福尼亚州圣地亚哥举行的第 66 届美国血液学会 (ASH) 年会暨博览会上发表三篇演讲。演讲将包括支持 nuvisertib 的新临床数据,nuvisertib 是一种正在研究用于治疗复发/难治性骨髓纤维化 (MF) 的试验性小分子,以及 enzomenib,一种正在研究用于治疗复发/难治性急性白血病的试验性口服小分子。正在进行的 nuvisertib 1/2 期研究的结果继续支持 nuvisertib 单药治疗耐受性良好,没有剂量限制性毒性 (DLT) 并且早期临床活动前景光明。目前,这项全球研究正在扩大,以评估 nuvisertib 与 JAK 抑制剂芦可替尼(首个获批的 JAK 抑制剂)和 momelotinib(最近获批用于治疗贫血症 MF 患者的 JAK 抑制剂)的联合使用,以评估安全性和临床活性。此外,来自 enzomenib 1/2 期研究的新临床数据显示,在广泛治疗剂量范围内的患者中,该疗法均表现出有希望的临床活性,并且安全性数据令人鼓舞,因为 enzomenib 耐受性良好,未观察到 DLT 或因与 enzomenib 相关的不良事件而停药的案例。SMPA 肿瘤科首席医疗官 Jatin Shah 医学博士表示:“对于复发性 AML 或骨髓纤维化患者,迫切需要新的有效治疗方案,以显著改善这些癌症相关的不良预后。这些数据让我们备受鼓舞,我们将继续快速推进复发/难治性 MF 和急性白血病的开发项目。” “我们期待在 12 月即将召开的会议上分享最新结果,这进一步支持 nuvisertib 和 enzomenib 的开发,并将继续致力于推进我们产品线中的新发展。”
布洛芬(伦理)100 mg/5 ml口服悬架
骨髓抑制是剂量依赖性的,主要表现为中性粒细胞减少症。在拥抱研究中,有82%的接受HALAVEN治疗的乳腺癌患者发生中性粒细胞减少症,患有严重的中性粒细胞减少症(> 3级),其中57%的患者在<1%的患者中停用(请参阅第4.8节不可避免的影响)。在软组织肉瘤研究(STS种群)中用eribulin治疗的患者中,中性粒细胞减少症(不良事件和实验室异常)发生在76.0%中,53%的患者患有严重的中性粒细胞减少症(≥3级)。在每剂量halaven之前,应对所有患者进行全血数量的监测。Halaven的治疗只能在ANC值≥1.5x 10 9 /L和血小板> 100 x 10 9 /L的患者中启动。在接受Halaven治疗的患者中,发生了<5%的患者中性粒细胞减少症。应根据建议的剂量治疗患有高温性中性粒细胞减少症,严重中性粒细胞减少症或血小板减少症的患者(请参阅第4.2节和给药方法)。ALT或AST> 3 x ULN患者的4级中性粒细胞减少症和热中性粒细胞减少症的发生率更高。尽管数据有限,但胆红素> 1.5 x ULN患者的4级中性粒细胞减少症和热中性粒细胞减少症的发生率也更高。在临床研究中,与白人受试者相比,亚洲和太平洋岛民受试者比例更高的亚洲和太平洋岛民受试者报告了中性粒细胞减少症的事件和/或实验室值的变化降低(请参阅第4.8节不良影响)。