XiaoMi-AI文件搜索系统
World File Search System将肥胖参与者纳入药物研发
肥胖是一个全国性的健康问题,在过去 20 年里,美国成年人的肥胖率从 30% 上升到 43%。1 重要的是,肥胖还会增加患糖尿病、高血压、心血管疾病、呼吸衰竭和癌症等其他并发症的风险。2–4 因此,美国临床药理学学会 (ACCP) 发出行动呼吁,旨在在药物开发过程中及时将肥胖参与者纳入临床试验。我们提出了一份路线图,建议在临床试验中纳入肥胖参与者,同时考虑疾病流行病学、合并症、药代动力学 (PK)、药效学 (PD)、试验药物的疗效和安全性,并鼓励通过基于模型的数据集成进行证据综合,以优化治疗剂量并最大限度地提高目标患者群体的效益与风险。随着美国肥胖症的患病率不断上升,理想的情况是,在健康志愿者中进行的 I 期研究和在患者中进行的后期 II/III 期临床试验中,有更多此类人群的代表。在健康志愿者中进行的典型 I 期临床药理学试验往往有纳入和排除标准,限制那些体型、体重或身体质量指数 (BMI) 不在特定“健康”范围内的人参与。这些典型的试验设计未能认识到在临床开发后期评估的实际目标患者群体中,体型/体重/BMI 的分布可能存在重要差异。了解这些差异,再加上对研究药物的临床药理学特征对体重增加相关的生理变化的预期敏感性的评估,可以为评估 PK 的 I 期策略提供更好的信息,
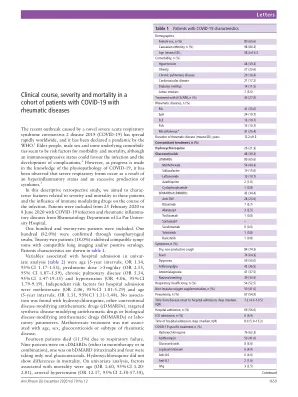
表 1 COVID-19 患者特征
在这项描述性回顾性研究中,我们旨在描述这些患者的严重程度和死亡率相关特征以及免疫调节药物对感染病程的影响。研究对象为 2020 年 2 月 25 日至 2020 年 6 月 8 日期间在拉巴斯大学医院风湿病科就诊的患有 COVID-19 感染和风湿性炎症疾病的患者。共纳入 122 名患者。其中 100 名(82.0%)通过鼻咽拭子确诊。22 名患者(18.0%)表现出相符的症状,且肺部影像学检查结果相符和/或血清学检查呈阳性。患者特征如表 1 所示。单因素分析显示(表2),与住院相关的变量包括年龄(5年间隔;OR 1.34,95% CI 1.17-1.55)、泼尼松剂量>5mg/天(OR 2.55,95% CI 1.07-5.59)、慢性肺部疾病(OR 5.34,95% CI 1.47-19.35)和高血压(OR 4.06,95% CI 1.79-9.19)。住院的独立危险因素是甲氨蝶呤(OR 2.06,95% CI 1.01-5.29)和年龄(5年间隔;OR 1.31,95% CI 1.11-1.48)。未发现与羟氯喹、其他常规抗风湿药物 (cDMARDs)、靶向合成抗风湿药物或生物抗风湿药物 (bDMARDs) 或实验室参数有任何关联。甲氨蝶呤治疗与年龄、性别、糖皮质激素或风湿病亚型无关。14 名患者 (11.5%) 死于呼吸衰竭。9 名患者使用 cDMARDs(单药或联合治疗),1 名使用 bDMARD(利妥昔单抗),4 名仅服用口服糖皮质激素。羟氯喹在死亡率方面没有差异。单变量分析显示,与死亡率相关的因素包括年龄(OR 1.60,95% CI 1.20-2.01)、动脉高血压(OR 12.17,95% CI 2.58-57.38)、
吸入的泛突激酶抑制剂Nezulcitinib在Covid-19患者中的功效和安全性:2期临床试验的结果
抽象背景吸入的肺选择性泛 - 果酶激酶抑制剂nezulcitinib在第二阶段试验的第1部分中具有有利的安全性和潜在疗效信号,在严重的Covid-19患者中,支持第2部分。方法第2部分是一项随机的双盲阶段2研究(NCT04402866)。年龄在18-80岁的住院患者,患有确认的症状性共vid-19,需要补充氧气(不包括基线侵入性机械通气)1:1与雾化的Nezulcitinib 3 mg或安慰剂3 mg或安慰剂或安慰剂,最多7天,使用背景标准疗法(包括皮质类固醇)。功效终点包括至今第28天的无呼吸衰竭(RFF)作为主要终点。次要终点包括安全性和从基线氧饱和度(SAO2)/第7天启发的氧(FIO2)比的比例,而28天死亡率是预先指定的探索性终点。在2020年6月至2021年4月之间的结果中,接受了205例患者(Nezulcitinib,103;安慰剂,102)。在主要终点(RFF天;中位数,21.0 vs 21.0; p = 0.6137)或次级功效端点中,Nezulcitinib与安慰剂之间没有统计学上的显着差异。nezulcitinib通常具有良好的安全性。得出结论,尽管预先指定的原发性,次要和探索性疗效终点(包括RFF到第28天),但未达到第7天的基线SAO2/FIO2比率,而未达到28天死亡率,但NEZULCITINIB通常可以容忍良好,并且具有良好的安全性。需要进一步的研究来确定Nezulcitinib的治疗是否在COVID-19患者的特定炎症生物标志物定义的特定生物标志物群体中赋予临床益处。
从糖尿病到透析:探索大流行期间不受控制的2型糖尿病的急性并发症
患者1:2021年1月,一名具有肥胖史的16岁女性(BMI = 46.1),代谢综合征和最近的Covid-19感染(2个月前),急诊科(ED)伴有糖尿病性酮症酸酸(ED),患有糖尿病性酮症酸病(DKA)和高渗透性超乳清性高血糖综合症(HHS)。她在3小时后的GCS = 10后变得无反应。在演示文稿中,实验室值为淀粉酶1231 U/L,脂肪酶4274 U/L,葡萄糖> 2000 mg/dl,pH 7.080,HCO3 9 mmol/L,AST 20 U/L,Alt 27 U/L,Alt 27 U/L,BUN 45 mg/dl,CR 6.1 mg/dl,Cr 6.1 mg/dl,和Hba 1 12.3%。腹部和骨盆的CT扫描显示出急性坏死性胰腺炎。尽管流体的维持率为1.5倍,肌酐仍在继续增加(6.1至7.2 mg/dl),并且尿量最小(<50 mL)。患者需要插管和机械通气,这是由于低血压(80-90/50)和呼吸衰竭而导致的。连续肾脏替代疗法(CCRT)是由于肾衰竭和电解质紊乱而开始的。她在过渡到每周3倍的透析时间表之前,接受了持续的低效率透析(雪橇)8天。在她46天住院的过程中,肾功能逐渐改善,并通过适当的尿量和电解质的标准化;因此,透析在23天后停止。她在氨氯地平,加巴喷丁和胰岛素方案上出院。出院四个月后,她被诊断出患有本质高血压,并开始使用赖诺普利(Lisinopril)。她之后是儿科肾脏病和内分泌学来管理她的慢性疾病。她的血糖继续保持升高,患者报告偶尔不遵守药物。
lifileucel 悬浮液 (Amtagvi) MNG-066
• 不受控制的脑转移;或 • 器官移植或之前的细胞转移;或 • 葡萄膜或眼部黑色素瘤;或 • 因任何原因接受全身性类固醇治疗;或 • 肿瘤切除前 14 天内出现 2 级或以上出血;或 • 左心室射血分数 (LVEF) < 45%;或 • 纽约心脏协会 (NYHA) 心力衰竭分类大于 1;或 • 1 秒用力呼气量 (FEV 1 ) < 60% 考虑服务时 研究性保险不适用于研究性医疗治疗或程序、药物、设备或生物制品。根据对现有数据的审查,健康计划认为,当患者选择标准未得到满足时(除上述标记为非医学必要** 的患者外),lifileucel(Amtagvi)的使用属于研究性质。*背景/概述 Amtagvi 是一种肿瘤衍生的自体 T 细胞免疫疗法,用于治疗成人不可切除或转移性黑色素瘤,这些黑色素瘤患者之前曾接受过程序性死亡受体 1 (PD-1) 阻断抗体治疗,如果 BRAF V600 突变呈阳性,则使用 BRAF 抑制剂(可联合或不联合 MEK 抑制剂)。它由从一个或多个肿瘤病变中切除的患者肿瘤组织制成,主要由 CD4+ 和 CD8+ T 细胞谱系的 T 细胞组成。输注前,患者应接受淋巴细胞清除化疗,包括环磷酰胺和氟达拉滨。Amtagvi 在完成淋巴细胞清除化疗后 24 小时至 4 天内给药。完成 Amtagvi 输注后,静脉注射白细胞介素 2 (IL-2),以 Proleukin ®‡(阿地白介素 IV 输注)的形式给药,最多 6 剂(每 8-12 小时给药一次)以支持体内细胞扩增。治疗必须在制造商认证的治疗中心进行。该产品标签上有治疗相关死亡、长期严重血细胞减少、心脏疾病、呼吸衰竭和急性肾衰竭的黑框警告。
ALS候选药物患者的II期临床试验...
血脑屏障(BBB),在2024年4月10日,法国的ALS Clermont -Ferrand和Lyon等神经退行性疾病中受到损害 - 法国生物制药公司Axoltis Pharma,致力于开发神经变性疾病的治疗解决方案,以开发神经化的疾病,以开发法国的授权。这项II期候选药物NX210C对肌萎缩性侧索硬化症患者(ALS)的临床试验是第一个针对血液脑屏障(BBB)完整性的临床试验。als是一种致命的神经退行性疾病,随时影响欧洲50,000名患者,每年造成10,000人死亡。它主要影响大脑和脊髓中的运动神经元。这导致肌肉无力和麻痹,大多数患者平均屈服于呼吸衰竭,平均为两到五年。今天,ALS无法治愈,欧盟中唯一获得批准的药物是riluzole,延长了仅两个月的中位生存期。因此,ALS仍然是高未满足需要的进行性致命的神经系统疾病。已经表明,在几种神经退行性疾病(例如ALS)中,BBB可以防止不良血液成分交叉进入大脑,甚至可能是疾病驱动的。Axoltis的NX210C是一种创新的治疗剂,除了提供神经保护和促进神经传递外,还可以帮助BBB恢复其完整性。nx210c是由12型氨基酸的循环肽,该氨基酸是根据SCO串联蛋白的1型血小板蛋白重复序列设计的。“在ALS患者中恢复BBB完整性的治疗方法非常有前途;在Axoltis,我们很荣幸能与NX210C一起在诊所中有明显的开端。“使用先进的分析方法将提供一种新的方法来解决ALS,并有助于理解整体神经退行性疾病。”
心血管重症监护病房(CVICU)临床奖学金
引言在第四纪心脏护理中心的心脏手术患者的术后护理发生在专用的心血管重症监护病房(CVICU)中。目前,重症监护医学(CCM)的培训缺乏足够的CVICU人群接触。在术前和术后心脏手术患者中,机械支撑设备的复杂性日益增加,并扩大了使用额外的技能。我们独特的CVICU临床奖学金使CCM医生能够获得额外的临床经验和技能,为心脏手术患者提供术后护理状态。临床研究员在加拿大艾伯塔省埃德蒙顿的Mazankowski Heart Institute(Mahi)的CVICU培训。这是一个完全由对心血管ICU特别感兴趣的强化主义者组成的26张床子专科单元。每年有1400多个入院。我们的CVICU是全面的;我们为常规的冠状动脉搭桥术,瓣膜心脏手术,胸主动脉手术,肺栓塞切除术和成人先天性心脏心脏手术提供护理。此外,我们还有一个大容量移植程序(心脏,心脏肺和肺),额外的有形生命支持(ECLS)护理(后手术后手术,作为移植的桥梁,以及严重的心脏病和呼吸衰竭)以及心室辅助装置(VAD)服务(暂时且耐用)。临床工作包括在8个CVICU轮换期间的夜间和周末内通话(28天内最多7个呼叫轮班)。国际学员申请人必须拥有政府/机构资金。奖学金计划这一一年奖学金包括CVICU的8个临床旋转,以及研究/质量改进的选定旋转(学术项目),超声心动图(经胸腔和经食道),心脏麻醉,移植和心室辅助设备。为加拿大学员提供的资金和资格资金由重症监护医学系CVICU研究与教育基金提供,并与艾伯塔大学的其他奖学金计划相称。此外,在奖学金开始之前,需要加拿大政府的工作许可。
杜氏肌营养不良症的综合回顾
治疗;诊断;症状;遗传学。1. 引言杜氏肌营养不良症 (DMD) 是一种 X 连锁隐性疾病,由编码肌营养不良蛋白的 DMD 基因突变引起。DMD 的病理特征是细胞骨架蛋白的完全缺失 [1]。DMD 的临床特征是进行性肌无力,肌肉脆性主要分布在近端肢体、颈部和胸部 [2]。DMD 是最常见的肌营养不良症,也是最常见的致命神经肌肉疾病之一,每 3,500 名新生男婴中就有 1 名患有此病 [3]。临床表现始于儿童早期,伴有进行性肌肉萎缩和无力,最终导致死亡。蛋白质缺陷在出生时就存在,但通常直到出生后第二年或第三年才会在临床上观察到并诊断出来。这种疾病最终导致患者在 12 岁左右无法行走,需要使用轮椅,肌肉无力导致严重的脊柱侧弯,并最终在 25 岁左右因心脏和/或呼吸衰竭而死亡,尤其是那些不选择呼吸机支持的患者 [2]。人类 DMD 基因位于 Xp21.2 位点,主要在骨骼肌中产生杆状细胞质结构蛋白,在心肌、平滑肌、脑神经细胞和视网膜中存在同工型 [4–6]。人类的 DMD 基因为 2.3 Mb,有 79 个外显子,产生 14 kb RNA 和 427 kDa 蛋白质 [5,7,8]。三分之一的 DMD 病例是由新生突变引起的,三分之二的病例有家族史,通常是女性携带者 [9]。贝克尔肌营养不良症 (BMD) 是一种不太严重的肌营养不良症,症状与 BMD 相似,但进展较慢且不太严重 [10]。统计分析发现,DMD 的全球患病率是 BMD 的三倍 [11]。全球 DMD 患病率约为每 100,000 名男性中有 7.1 人,而普通人群中每 100,000 人中有 2.8 人。DMD 的发病率为每 100,000 人中有 19.8 人
月度回顾 - MyNavy HR - Navy.mil
药物过量预防:CDC 估计,2022 年因药物过量死亡的 112,000 多人中,近 70% 的死亡是由芬太尼引起的。在青少年中,84% 的致命过量与芬太尼有关。芬太尼是一种强效的合成阿片类镇痛药,最初是为治疗癌症等严重或慢性疾病患者的疼痛而开发的。它的效力大约是吗啡的 100 倍,大约是海洛因的 50 倍。它有多种形式,包括透皮贴剂、含片和注射液。然而,芬太尼的非法生产和分销严重加剧了阿片类药物危机。非法制造的芬太尼经常与其他药物混合,如海洛因或可卡因,而使用者往往对此毫不知情。这增加了过量服用的风险,因为使用者可能不知道他们所服用物质的效力。芬太尼通过与大脑中控制疼痛和情绪的阿片类受体结合而起作用。这种结合会降低疼痛感,并产生欣快感。然而,它也会抑制呼吸系统,导致呼吸衰竭和死亡,尤其是与酒精等其他中枢神经系统抑制剂结合时。芬太尼过量服用的症状包括瞳孔缩小、嗜睡、意识模糊、昏迷和呼吸抑制。纳洛酮(商品名“Narcan”)是一种阿片类拮抗剂,如果及时使用,可以逆转芬太尼过量的影响。在 67% 的青少年用药过量死亡案例中,有旁观者在场,可以进行干预。Narcan 鼻喷雾剂可在网上或 Walgreens、CVS、Target、Walmart 等零售商处购买。除非药物由持牌医疗专业人员开具处方并由合法药房配发,否则您无法知道它是假药还是真药。如果不进行实验室检测,就无法知道单个药丸中的芬太尼含量或可能添加到另一种药物中的芬太尼含量。建议儿童避免使用未知物质,切勿共用药物。强调如果遇到任何可疑物质,寻求帮助的重要性。对于面临精神和/或物质使用障碍的个人和家庭,提供治疗转介和信息的全国帮助热线是 1-800-662-HELP (4357)。
Zydus 宣布获得美国食品药品监督管理局 (FDA) 孤儿药称号……
印度艾哈迈达巴德,2025 年 1 月 22 日 Zydus 是一家领先的、以发现为基础的全球制药公司,今天宣布美国食品药品监督管理局已授予新型口服 NLRP3 抑制剂 Usnoflast 孤儿药资格 (ODD),用于治疗肌萎缩侧索硬化症 (ALS)。美国食品药品监督管理局孤儿药办公室授予孤儿药资格以支持开发用于治疗影响美国不到 200,000 人的罕见疾病的药物。在谈到这一进展时,Zydus Lifesciences Limited 董事长 Pankaj Patel 表示:“美国食品药品监督管理局授予的这一孤儿药资格强调了开发 Usnoflast 以治疗致命的神经退行性疾病肌萎缩侧索硬化症 (ALS) 的迫切需要。Zydus 致力于开拓神经科学的新前沿,并为 ALS 患者开发 Usnoflast。”患有 ALS 的人从确诊到死亡的平均存活期约为 2 至 5 年,大多数 ALS 患者死于呼吸衰竭。ALS 患者会出现神经炎症和快速神经退化。轴突神经退化会导致神经丝形成,这些神经丝首先在 ALS 患者的脑脊液中积聚,然后慢慢进入血液循环。由于快速神经退化,ALS 患者逐渐丧失移动、说话、进食的能力,最终导致呼吸、瘫痪和死亡。根据美国疾病控制和预防中心 (CDC) 的统计数据,ALS 影响了美国约 32,000 人,美国每年平均有 5,000 名新患者被诊断出患有此病。据估计,欧洲(欧盟和英国)有超过 30,000 人患有 ALS,而印度估计有 75,000 人患有 ALS。Usnoflast (ZYIL1) 是一种新型口服小分子 NLRP3 抑制剂。 Usnoflast 已在神经炎症、帕金森病、炎症性肠病 (IBD) 和多发性硬化症 (MS) 的几种临床前模型中进行了研究。美国食品药品监督管理局此前已授予 Zydus “孤儿药称号”,用于