XiaoMi-AI文件搜索系统
World File Search System使用人多能干细胞衍生的视网膜片的手术成功闭合
Akiba R,Masuda T,Yokota S,Yonemura S,Nishida K,Takahashi M,Kurimoto Y,MandaiM。干细胞报告。2024 doi:10.1016/j.stemcr.2024.09.002。※epub在印刷前。pmid:39366379。
引导多能干细胞分化以实现心脏细胞多样性
旨在表征和研究调控性数量性状基因座 (QTL) 的研究也揭示了个体之间的表型差异,包括疾病风险和药物反应的差异。调控性 QTL 效应高度依赖于环境,可能仅在特定条件下表现出来。原则上,诱导性多能干细胞 (iPSC) 可以分化成体内的任何细胞类型,当与单细胞 RNA 测序相结合时,iPSC 能够在不同环境中大规模映射调控性 QTL。挑战在于找到一种方法来快速扩展我们可以表征的细胞类型和细胞状态的维度。为了解决这个问题,我们开发了一种引导式 iPSC 分化方案,可以快速生成时间和功能各异的心脏相关细胞类型。在短短 8-10 天内,我们就能持续复制在费力的定向分化时间进程研究中看到的心脏祖细胞,以及成熟心脏类器官中存在的终末细胞类型。利用引导分化,人们可以快速表征空间和时间多样化的心脏细胞类型中的调控变异和基因与环境的相互作用。
在使用诱导多能的使用方面有希望的发展...
最初发表于:Yde Ohki,Cristine Marie; McNeill,Rhiannon V;尼伯勒,马蒂亚斯; Radtke,Franziska; Kittel-Schneider,Sarah;格伦布拉特,埃德娜(2022)。在ADHD研究中使用诱导多能干细胞的有希望的发展。in:斯坦福大学,S Clare; Sciberras,Emma。注意力缺陷多动障碍行为神经科学中的新发现。纽约:施普林格,483-501。doi:https://doi.org/10.1007/7854_2022_346
人类诱导的多能干细胞的扰动细胞图集
Hope A. Tanis是1:2.3.4,Anna S.E.1,2,3,5,5,Ben Weisbur 7,2,3,Angli Xue 12,13,Michael Gray 12.13和Andre L.M. Reiz 3,14,Jonathan Margoliash 15,John Marshall 1:2,3,Bakiris Vivian 3:14,12:14,Stuart I. Alexander 4.24 4.24,Owen M. Siggs 1,2,3,Hannah R.Nicholas 1:2,3,1:2,3,1:2,3,1:2,3,1:2,3,3,2,3,2,3,2,3,2.2,3,2,1,2,3,5,5,Ben Weisbur 7,2,3,Angli Xue 12,13,Michael Gray 12.13和Andre L.M. Reiz 3,14,Jonathan Margoliash 15,John Marshall 1:2,3,Bakiris Vivian 3:14,12:14,Stuart I. Alexander 4.24 4.24,Owen M. Siggs 1,2,3,Hannah R.Nicholas 1:2,3,1:2,3,1:2,3,1:2,3,1:2,3,3,2,3,2,3,2,3,2.2,3,2,1,2,3,5,5,Ben Weisbur 7,2,3,Angli Xue 12,13,Michael Gray 12.13和Andre L.M.Reiz 3,14,Jonathan Margoliash 15,John Marshall 1:2,3,Bakiris Vivian 3:14,12:14,Stuart I. Alexander 4.24 4.24,Owen M. Siggs 1,2,3,Hannah R.Nicholas 1:2,3,1:2,3,1:2,3,1:2,3,1:2,3,3,2,3,2,3,2,3,2.2,3,2,Reiz 3,14,Jonathan Margoliash 15,John Marshall 1:2,3,Bakiris Vivian 3:14,12:14,Stuart I. Alexander 4.24 4.24,Owen M. Siggs 1,2,3,Hannah R.Nicholas 1:2,3,1:2,3,1:2,3,1:2,3,1:2,3,3,2,3,2,3,2,3,2.2,3,2,
鉴定多能胚胎干细胞生物学的钥匙细胞 - 细胞相互作用
上下文细胞间交流对于多细胞生物的发展和维护至关重要。最近的研究强调了哺乳动物胚胎中胚外细胞(滋养剂和低纤维细胞)和多能胚胎细胞(epiblast)之间通信的重要性[1,2,3]。具体而言,由小细胞产生的细胞外基质在控制多脂蛋白层状干细胞的细胞增殖中起关键作用。我们对猪胚胎干细胞的研究已经证实了细胞外基质在影响调节层细胞多能性的信号通路和转录因子中的重要性[4]。我们最原始的观察结果之一依赖于四叠蛋白CD9,CD81和CD63表达的检测主要是在滋养剂中(未发表)。这些四翼烷蛋白是细胞外囊泡(EV)的已知标记,它们是各种细胞类型的小脂质囊泡[5]。evs参与将信号蛋白,细胞因子和转录因子转运到受体细胞,影响各种过程,包括免疫反应,肿瘤进展和胚胎发育[6,7]。尽管已经在小鼠胚胎中研究了胚胎和胚外细胞之间的EV介导的细胞对细胞通信,但焦点主要是由小鼠多能干细胞分泌的电动汽车[8,9]。这项研究旨在研究EVS在促进交流和影响这些细胞类型的生物学的促进性滋养剂细胞和多能细胞分泌的电动汽车的作用。这项研究由ANR STEM4PIGS(2025-2028)资助,并将支持从2025年9月开始的博士生。
多能建筑物中混合可再生能源系统功能整合的概述
摘要:线弧添加剂制造(WAAM)以其高沉积速率而闻名,从而使大部分生产。然而,该过程在制造铝制零件时面临诸如孔隙率形成,残留应力和破裂的挑战。本研究的重点是通过使用Fronius冷金属转移系统(Wels,Austria)使用WAAM工艺制造的AA5356墙的孔隙率。将墙壁加工成以获取用于拉伸测试的标本。该研究使用计算机断层扫描和拉伸试验来分析标本的孔隙率及其与拉伸强度的潜在关系。分析的过程参数是行进速度,冷却时间和路径策略。总而言之,由于对焊接区域的热量输入较低,增加行进速度和冷却时间显着影响孔径。孔隙率可以减少热量积聚。结果表明,旅行速度的增加会导致孔隙率略有下降。特别是,当将旅行速度从700毫米/分钟提高时,总孔体积从0.42降低到0.36 mm 3。最终的拉伸强度和“来回”策略的最大伸长率略高于“ GO”策略的策略。在拉伸测试后,最终的拉伸强度和屈服强度与计算机断层扫描测量的孔隙率没有任何关系。对于所有扫描标本,测得的体积上孔总体积的百分比低于0.12%。
来自人类多能干细胞的脑类器官的模式化
摘要 源自人类多能干细胞的脑类器官这一新兴技术为研究人脑发育及相关疾病提供了前所未有的机会。人们已开发出各种脑类器官方案,这些方案可以重现发育中人脑的细胞类型多样性、细胞结构组织、发育过程、功能和病理的一些关键特征。在这篇综述中,我们重点介绍人类干细胞衍生的脑类器官的模式化。我们首先概述了生成脑类器官的一般程序。然后,我们重点介绍了一些最近开发的脑类器官方案和化学线索,这些方案和线索涉及模拟特定人脑区域、亚区域和多个区域共同发育。我们还讨论了人脑类器官技术的局限性和未来潜在的改进。
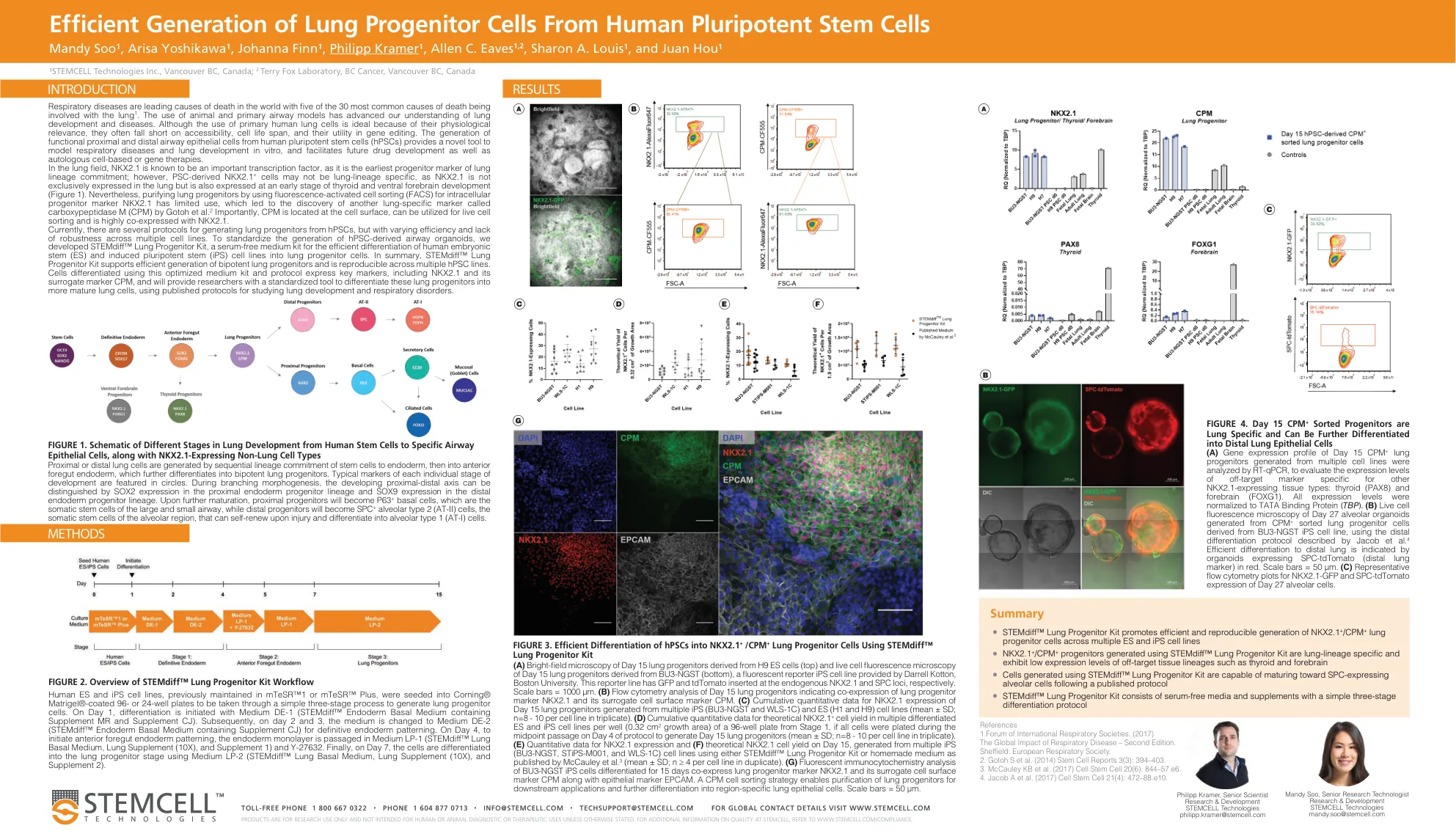
SP00248-从人类多能干细胞高效生成肺祖细胞
近端或远端肺细胞是由干细胞按顺序谱系分化到内胚层,然后进入前肠内胚层,进一步分化为双能肺祖细胞而产生的。每个发育阶段的典型标记以圆圈表示。在分支形态形成过程中,可以通过近端内胚层祖细胞谱系中的 SOX2 表达和远端内胚层祖细胞谱系中的 SOX9 表达来区分发育中的近端-远端轴。进一步成熟后,近端祖细胞将变成 P63 + 基底细胞,即大气道和小气道的体细胞干细胞,而远端祖细胞将变成 SPC + 肺泡 2 型 (AT-II) 细胞,即肺泡区域的体细胞干细胞,它们在受伤后可以自我更新并分化为肺泡 1 型 (AT-I) 细胞。
了解胚胎干细胞中多能性命运转变的调节
胚胎干细胞(ESC)来自胚泡的内部细胞质量,类似于该组织的功能,但缺乏形成所有胚外结构的能力。MESC是瞬态细胞群,表达了2细胞(2C)胚胎的高水平转录本特征,并被鉴定为“ 2细胞类似细胞”(2clcs)。先前的研究表明,在重新引入早期胚胎后,2CLC可以有助于胚胎和胚外组织。大约1%的MESC从多能MESC动态过渡到2Clcs。然而,哺乳动物胚胎的稀缺性对整体细胞的分子表征构成了重要挑战。迄今为止,以前的研究探索了将多能细胞重编程为全能细胞的各种方法。虽然对维持ES多能性的分子调节网络有很好的了解,但多能ESC将重编程重新编程为整体细胞的过程以及对全能调节的相关分子机制仍然很熟悉。本综述综合了对ESC重编程为2CLC的调节途径的最新见解,探索了由转录调节剂,小分子和表观遗传变化调节的分子机制。目的是为研究人员的领域构建一个理论框架。
在早期哺乳动物发育中多能培养细胞的出现
我们的项目是了解植入前小鼠胚胎中细胞谱系分化的遗传机制。我们对在小鼠中最初3天进行的层细胞(EPI)和原始内胚层细胞(PRE)之间的区分特别感兴趣,对应于人类的前6天。这些细胞将产生未来个体及其后代的所有细胞。此外,EPI是著名的ES多能干细胞的来源或类似于IPS重编程的细胞的来源。这些细胞具有提供任何胚胎或成人细胞类型的能力,因此具有巨大的细胞治疗潜力。我们的团队正在研究胚胎细胞中如何获得这些“多能”特性及其分化方式。我们还正在分析它们与前和滋养剂的相邻组织的关系,后来分别参与了蛋黄囊和胎盘的形成。