XiaoMi-AI文件搜索系统
World File Search System有效和选择性Tyk2降解器,没有JAK活动,有效并完全抑制IL12/23和IFN-A信号通路
引言TYK2是激酶的JAK家族的成员,它结合了IL-12,IL-23和I型IFN受体,以募集和磷酸化信号转录器以及转录(STAT)转录因子的激活(STAT)。功能变异的丧失在自身免疫性疾病中具有保护性,而TYK2的变构抑制剂(Deucravacitinib)以及针对IL-12,IL-23和IFN-α的生物学剂已批准用于治疗多种自身免疫性疾病,使TYK2的治疗方法是具有极具吸引力的目标。tyk2,p1104a的常识变体,使蛋白质催化无效的蛋白质仍然支持通过I型IFN途径的信号传导,这表明抑制I型IFN需要阻止脚手架函数。此外,批准或临床发育中的TYK2抑制剂尚未在临床相关剂量时显示出完全靶标的抑制作用。
抑制ULK1/2介导的自噬增强抗原加工和表现 ARC-9:一项评估基于伊特鲁马德的治疗组合的随机研究
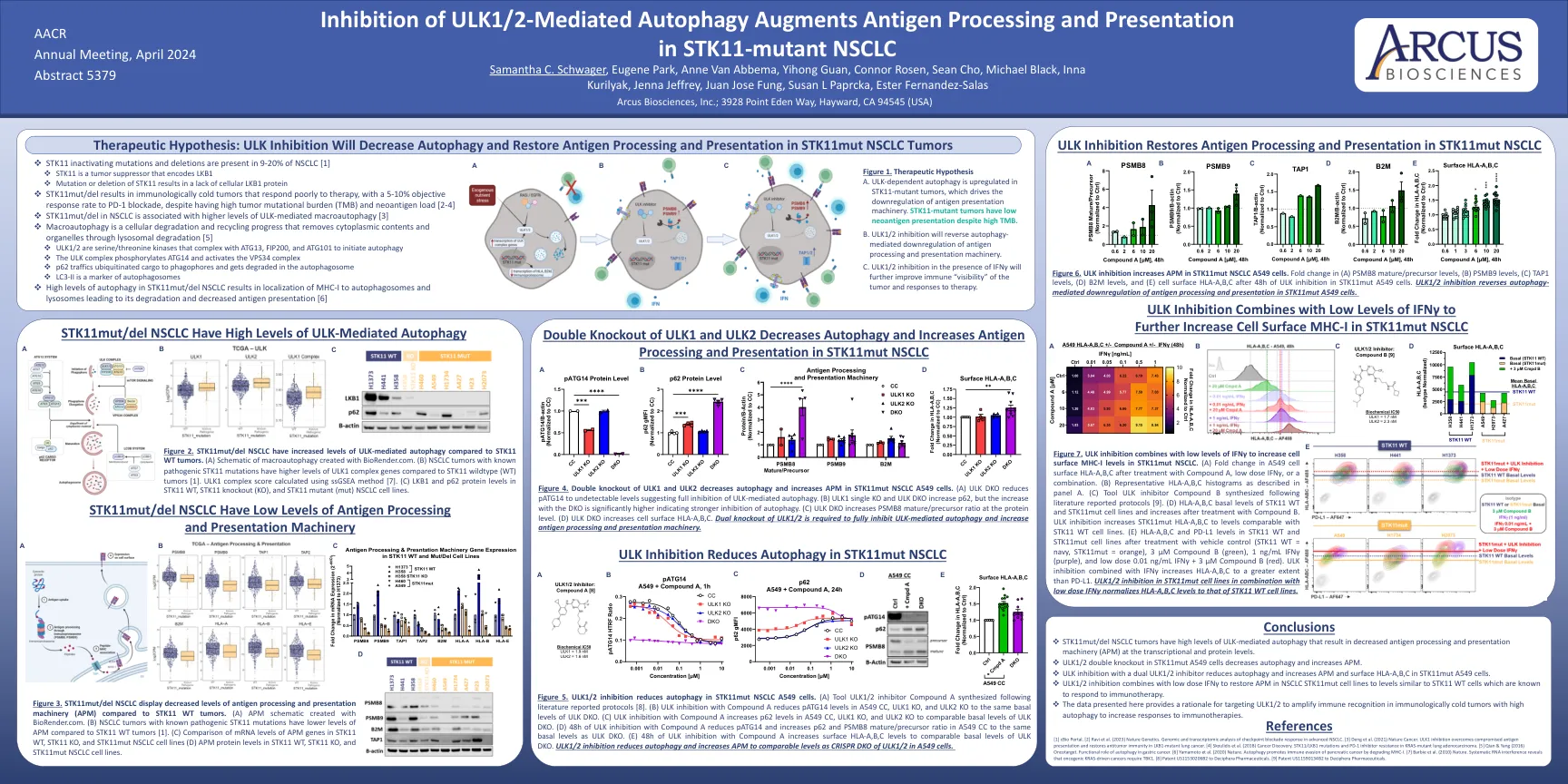
图2。与STK11 WT肿瘤相比, STK11MUT/DEL NSCLC具有ULK介导的自噬水平升高。 (a)用biorender.com创建的大噬细胞的示意图。 与STK11野生型(WT)肿瘤相比,具有已知致病性STK11突变的NSCLC肿瘤具有更高水平的ULK1复合基因[1]。 ULK1复合分数使用SSGSEA方法计算[7]。 (C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。 图4。 ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。 (a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。 (b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。 (c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。 (d)ULK DKO增加了细胞表面HLA-A,b,c。 需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。STK11MUT/DEL NSCLC具有ULK介导的自噬水平升高。(a)用biorender.com创建的大噬细胞的示意图。与STK11野生型(WT)肿瘤相比,具有已知致病性STK11突变的NSCLC肿瘤具有更高水平的ULK1复合基因[1]。ULK1复合分数使用SSGSEA方法计算[7]。 (C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。 图4。 ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。 (a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。 (b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。 (c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。 (d)ULK DKO增加了细胞表面HLA-A,b,c。 需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。ULK1复合分数使用SSGSEA方法计算[7]。(C)STK11 WT,STK11敲除(KO)和STK11突变体(MUT)NSCLC细胞系中的LKB1和P62蛋白水平。图4。ULK1和ULK2的双重敲除可降低自噬并增加STK11MUT NSCLC A549细胞中的APM。(a)ULK DKO将PATG14降低至无法检测的水平,表明对ULK介导的自噬完全抑制。(b)ULK1单个KO和ULK DKO增加了p62,但随着DKO的增加,dKO的增加表明自噬抑制更强。(c)ULK DKO在蛋白质水平上增加了PSMB8成熟/前体比率。(d)ULK DKO增加了细胞表面HLA-A,b,c。需要ULK1/2的双重敲除以完全抑制ULK介导的自噬并增加抗原加工和表现机制。
二维金属纳米片的原位表面定向组装用于抗生素耐药细菌的无药物治疗
图 4. 纳米血小板对细菌生长的抑制。(A)纳米血小板铜带样品在暴露于细菌之前和之后。由于纳米血小板溶解到细菌培养液中,出现了可见的颜色变化。(B)样品粘附在 24 孔板的孔中。上图显示暴露于细菌之前的样品,下图显示暴露于细菌之后的样品。(C)在纳米血小板存在下大肠杆菌的生长抑制。纳米血小板几乎完全抑制了细菌生长。数值代表平均值,误差线代表标准差(对照组 n=8,治疗组 n=4)。** 表示与对照组相比具有统计学显著性,P<0.01。NS=不显著。对照样品是未经处理的细菌溶液。(D)在纳米血小板存在下 MDR 大肠杆菌的生长抑制。纳米血小板几乎完全抑制了细菌生长。数值代表平均值,误差线代表标准差(对照组 n=8,治疗组 n=4)。 ** 表示与对照组相比具有统计学显著性,P<0.01。NS=不显著。对照样品是未经处理的细菌溶液。
泰国采后储存的大蒜鳞茎中蓝霉病原体的鉴定及其杀菌剂敏感性
摘要 青霉病是影响大蒜采后的主要病害之一。2023年,该病害在泰国清迈府的大蒜[Allium ampeloprasum var. ampeloprasum (Borrer) Syme]采后储藏期间被发现。从大蒜中分离得到3个真菌分离株,根据形态特征和核糖体DNA内部转录间隔区(ITS)、β -微管蛋白(BenA)、钙调蛋白(CaM)和RNA聚合酶II第二大亚基(rpb2)基因组合序列的系统发育分析,鉴定为大蒜青霉菌(Penicillium allii)。在致病性测定中,接种分离真菌的大蒜表现出与采后储藏期间观察到的症状相似的症状。在杀菌剂筛选试验中,多菌灵、苯醚甲环唑 + 嘧菌酯和苯醚甲环唑在半剂量和推荐剂量下均能有效完全抑制该真菌,而该真菌对克菌丹和代森锰锌不敏感。此外,多菌灵、氧氯化铜、苯醚甲环唑与嘧菌酯的组合以及苯醚甲环唑单独使用时,双倍推荐剂量可完全抑制该真菌。据我们所知,这是泰国首次报道由 P. allii 引起的大蒜鳞茎采后蓝霉病。此外,杀菌剂敏感性筛选的结果有助于制定有效的管理策略,以控制由 P. allii 引起的大蒜鳞茎采后蓝霉病。
RNase抑制剂 - 重组
描述:RNase抑制剂是一种重组蛋白,它完全抑制了包括RNase A,B和C在内的广泛的真核RNase,它通过以1:1的比率与高亲和力(4 x 10 -14 m)抑制RNase。它不抑制RNase I,T1,T2,H,U1,U2和CL3。此外,RNase抑制剂没有对聚合酶或逆转录酶活性的抑制作用,因此可用于cDNA合成和一步性RT-PCR反应。RNase抑制剂的鼠版本缺乏在人类版本中鉴定出的一对半胱氨酸,因此它显着提高了对氧化的耐药性。
Crovalimab(阵发性睡眠性血红蛋白尿,PNH)
即使在 COMMODORE 研究之后,这个问题仍然有很大的悬而未决。就结果而言,Crovalimab 被认为与抗体依库珠单抗相当;目前还没有与 ravulizumab 直接比较的数据。由于相关研究已经表明,接受 crovalimab 治疗的 PNH 患者血浆中的 C5 得到完全抑制,因此与 ravulizumab 类似,使用 crovalimab 可以显著改善 eculiuzumab 观察到的药代动力学相关突破性溶血。因此,接受 Crovalimab 治疗的 PNH 患者中描述的突破性溶血完全是在药效学上发生的,即在感染等外部补体激活条件 (CAC) 的背景下发生的。因此,对此的评估必须包括此类 CAC 的发生。
OnESTEP™PCR抑制剂去除套件
放大。PCR扩增被完全抑制。用于每个PCR的DNA,然后在2.0%(w/v)琼脂糖/tae/etbr凝胶中分析等效量的反应。梯子是100 bp的DNA标记(Zymo Research)。使用Zymotaq Premix(Zymo Research)进行热门PCR。使用OnESTEP™试剂盒或竞争对手去除PCR抑制剂后DNA恢复的比较。1KB梯子(Zymo Research)被稀释至各种浓度,并用QCR抑制剂去除套件或MN公司或Company MN的套件进行处理。DNA浓度,以计算每个试剂盒的恢复%。
Bayliss -Starling奖演讲:脊髓和皮质伤害性电路的发育生理学
■关于科学和数学中违反直觉概念的推理被认为需要抑制幼稚的理论,先验知识或通过抑制性控制误导感知线索。神经影像学研究表明,在违反直觉推理过程中,PFC区域募集了,这被解释为抑制性控制过程的证据。ever的结果不一致,并且尚未与行为或大脑活动直接进行比较。在这项FMRI研究中,有34名青少年(11 - 15岁)回答了科学和数学问题,并完全抑制了抑制任务(简单而复杂的GO/NO- GO)和一个干扰控制任务(数值Stroop)。与对照
重新启动卡住的丙二乳酸发酵是白色,桃红葡萄酒和红酒的最新简单快速协议
其他抑制化合物•某些酚类化合物可以抑制MLF,例如某些凝结的单宁,而其他类花青素也可以刺激它们。•已知农药残留物会导致MLF的缓慢,卡住或完全抑制•如果不使用正确的抗抗性细菌,则高L-乳酸含量(如果雄性酸初始水平高)可能会抑制MLF的良好实现。•使用壳聚糖或奇质衍生的新溶液进行处理会扰乱MLF的良好开始或完全实现,具体取决于葡萄酒状况和治疗时机。•某些酵母菌菌株,尤其是当它们努力完成酒精发酵时,可以释放有毒的代谢产物,从而引起MLF问题。•中链不饱和脂肪酸也会对细菌的生长和活性产生负面影响。
重新审视主调控因子在番茄成熟过程中的作用
番茄成熟转录调控的研究一直由转录因子 (TF) 基因的自发突变引领,这些突变会完全抑制正常成熟,表明它们是“主调节器”。使用 CRISPR/Cas9 诱变技术敲除潜在基因的研究表明情况有所不同,表明调控比以前认为的更为强大。这要求我们重新审视成熟调控模型,并将其替换为涉及部分冗余组件网络的模型。同时,与敲低技术相比,CRISPR/Cas 诱变技术的快速兴起导致出乎意料的弱表型,这表明补偿机制可能会掩盖蛋白质的功能。这强调了评估植物中的这些机制以及精心设计诱变实验的必要性。