XiaoMi-AI文件搜索系统
World File Search Systemiph4502 在选定的晚期实体肿瘤中
本新闻稿包含某些前瞻性陈述,包括适用证券法(包括 1995 年《私人证券诉讼改革法》)所定义的陈述。某些词语的使用,包括“预期”、“相信”、“可以”、“可能”、“估计”、“期望”、“可能”、“可能”、“潜在”、“期望”、“应该”、“将”或这些词语和类似表达的否定形式,旨在识别前瞻性陈述。尽管公司认为其预期是基于合理的假设,但这些前瞻性陈述受众多风险和不确定性的影响,这可能导致实际结果与预期结果大不相同。这些风险和不确定性包括但不限于研发固有的不确定性,包括与安全性、正在进行和计划中的临床试验和临床前研究的进展和结果、监管机构对其候选产品的审查和批准、公司对
将药物重新用于实体肿瘤治疗
摘要 癌症仍然是全球面临的重大健康挑战,除了化疗、放疗和分子靶向治疗等全身疗法之外,治疗选择有限。免疫疗法已成为一种很有前途的治疗方式,但其疗效已达到稳定水平,因此对癌症患者的益处有限。迫切需要找到更有效的方法来改善患者预后并延长生存期。药物再利用已成为一种有吸引力的药物开发策略,最近引起了人们的广泛关注。本综述全面分析了各种再利用药物在肿瘤发生中的功效,例如转化生长因子-β (TGF- β ) 抑制剂、二甲双胍、核因子 κ B 受体激活剂配体 (RANKL) 抑制剂、粒细胞巨噬细胞集落刺激因子 (GM-CSF)、胸腺肽 α 1 (T α 1)、阿司匹林和双膦酸盐,特别关注它们对肿瘤免疫学和免疫治疗的影响。此外,我们还简要概述了当前的临床前和临床研究,这些研究旨在探讨将这些药物与免疫检查点抑制剂相结合所实现的潜在治疗协同作用。关键词药物再利用;免疫检查点抑制剂;免疫疗法;肿瘤微环境
如何控制实体肿瘤靶向治疗的副作用
靶向治疗与免疫治疗被认为是过去十年肿瘤治疗领域最伟大的进步之一。它的有效性改变了整个肿瘤学的预后。靶向治疗的一般作用机制在于阻断负责肿瘤生长的异常信号通路。然而,考虑到这些信号通路也存在于健康细胞中,我们必须考虑可能产生的不利影响。肿瘤学实践中最常见和最严重的不良反应包括皮肤、血管、胃肠道、心脏、粘膜毒性和颌骨坏死。针对性治疗相关不良反应的管理部分包括告知患者治疗的预期并发症及其预防可能性。本文的目的是提供最常见的副作用的全面而简要的概述以及影响它们的选项。
开发治疗转移性实体肿瘤的新方法
本演示文稿中的信息由 Propanc Biopharma, Inc.(“公司”)仅供参考,并非购买或出售要约,或购买或出售公司任何证券或工具的要约邀请,或参与任何投资活动或交易策略,亦不构成在美国或任何其他地方签订的任何合同或承诺的基础或依据。通过查看或参与本演示文稿,您承认并同意 (i) 本演示文稿中包含的信息仅供接收者使用,不得以任何方式向任何其他人披露、复制或分发;(ii) 本演示文稿的任何部分或与此相关的任何其他材料均不得在本演示文稿之后复制、保留、带走、复制或重新分发;(iii) 所有参与者必须在演示文稿完成后将与此相关的所有材料退还给公司;(iv) 受上述限制的约束。
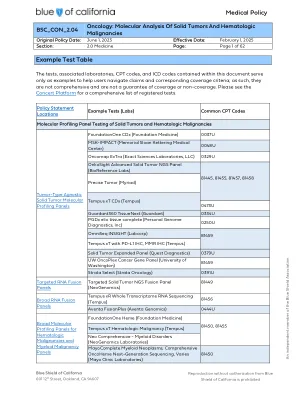
肿瘤学-分子分析-实体肿瘤-血液学-...
1. 疑似或已证实的转移性结直肠癌,或 2. 晚期或转移性非小细胞肺癌(NSCLC),或 3. III 期或 IV 期皮肤黑色素瘤,或 4. 需要活检的不确定的甲状腺结节,或 5. 未分化甲状腺癌,或 6. 局部复发、晚期和/或转移性乳头状甲状腺癌,或 7. 局部复发、晚期和/或转移性滤泡性甲状腺癌,或 8. 局部复发、晚期和/或转移性赫尔特尔细胞甲状腺癌,或 9. 低级别神经胶质瘤或毛细胞星形细胞瘤,或 10. 可切除或边缘可切除或局部晚期/转移性胰腺癌
TROP 2 过表达在特定实体肿瘤中的作用
滋养层细胞表面抗原 2 (TROP2) 受体蛋白,又称 GA733-1 (胃肠道抗原 733-1)、EGP-1 (上皮糖蛋白-1)、TACSTD2 (肿瘤相关钙信号转导子-2),是一种分子量为 36 kDa 的跨膜糖蛋白,最初在正常和肿瘤滋养层细胞中发现 [1, 2]。TROP2 是位于 1p32 染色体上的 TACSTD2 基因的蛋白质产物,该基因是一种细胞原癌基因。其突变导致获得致癌功能,从而决定原发性癌细胞的转化过程及其转移能力。 TROP2蛋白在内质网中合成,然后运输至高尔基体,在此进行糖基化。其表达于细胞膜表面及细胞质内,膜表达的存在与
TROP 2 过表达在特定实体肿瘤中的作用
滋养层细胞表面抗原 2 (TROP2) 受体蛋白,又称 GA733-1 (胃肠道抗原 733-1)、EGP-1 (上皮糖蛋白-1)、TACSTD2 (肿瘤相关钙信号转导子-2),是一种分子量为 36 kDa 的跨膜糖蛋白,最初在正常和肿瘤滋养层细胞中发现 [1, 2]。TROP2 是位于 1p32 染色体上的 TACSTD2 基因的蛋白质产物,该基因是一种细胞原癌基因。其突变导致获得致癌功能,从而决定原发性癌细胞的转化过程及其转移能力。 TROP2蛋白在内质网中合成,然后运输到高尔基体,在那里进行糖基化。其表达在细胞膜表面和细胞质内,膜表达的存在与
用于实体肿瘤突变检测的无细胞检测
推荐或推广第三方在本次研讨会上展示的任何赛默飞世尔科技产品的使用或应用。第三方展示或提供的信息和材料按原样提供,不提供任何形式的担保,包括有关知识产权和报告结果的担保。展示图像、文本和材料的各方表示他们有权这样做。
实体肿瘤中的 NTRK 基因融合和 TRK 抑制剂
摘要:拉罗替尼和恩曲替尼获批用于治疗携带 NTRK 基因融合的癌症患者,这是“组织学不可知”药物时代的一个里程碑。在促成这两种药物获批的临床试验中,大多数入组患者患有软组织肉瘤、肺癌和唾液腺癌。然而,随着新一代测序检测在临床环境中越来越普及,医疗保健专业人员可能能够检测到临床试验中未涉及或未涉及的肿瘤类型患者的 NTRK 基因融合。为此,我们系统地审查了 MEDLINE 从成立之初到 2022 年 8 月 31 日的病例报告和病例系列,这些病例报告和病例系列涉及使用 TRK 抑制剂治疗的 NTRK 基因融合阳性肿瘤患者。我们创建了一个由 43 名患者组成的虚拟队列,不包括参加上述临床试验的患者。尽管我们的结果与文献中现有的结果一致,但我们队列中登记了各种中枢神经系统肿瘤病例,证实了这些药物对这一亚组患者的益处。需要大型、多机构登记,以提供更多关于 TRK 抑制剂对临床试验中未涉及或未涉及的肿瘤类型癌症患者的疗效的信息。
抗癌双线作战——针对 TAM 受体的实体肿瘤治疗
摘要:受体酪氨酸激酶 (RTK) 是一种跨膜受体,可结合生长因子和细胞因子,并在其胞质域内含有受调节的激酶活性。RTK 在正常细胞和恶性细胞的信号转导中起着重要作用,其编码基因属于癌细胞中最常受影响的基因。TAM 家族蛋白 (TYRO3、AXL 和 MERTK) 参与多种生物过程:免疫调节、凋亡细胞清除、血小板聚集、细胞增殖、存活和迁移。最近的研究表明,TAM 在肿瘤发生和抗肿瘤免疫抑制方面具有重叠的功能。MERTK 和 AXL 在先天免疫细胞中起作用,以抑制炎症反应并促进免疫抑制性肿瘤微环境,而 AXL 表达与肿瘤的上皮-间质转化、转移和运动性相关。因此,TAM RTK 在癌症中代表双重靶点,因为它们在肿瘤细胞存活、迁移、化学抗性以及在肿瘤微环境 (TME) 中的免疫抑制作用中具有内在作用。在这篇综述中,我们讨论了 TAM 作为癌症治疗中新兴治疗靶点的潜力。我们严格评估和比较了目前针对实体瘤中 TAM RTK 的方法以及针对 TAM 受体激酶胞外和胞内域的新抑制剂的开发。