XiaoMi-AI文件搜索系统
World File Search System宿主种群异质性对流行病暴发的影响
标题表明,我们的目的是研究异质性如何影响人口封闭的宿主人群流行病的各个方面。特别是,我们专注于基本的繁殖数r 0,马尔萨斯参数r,最终大小,峰值和发射率的大小。该论文由两个部分组成。在第一部分中,我们采用了自上而下的方法。我们首先引入一个相当通用的模型。由于其表述采用了特征空间的措施,因此它涵盖了离散和连续的特征。我们提出的各种结果本质上已经闻名了很长时间,但这可能并不是“众所周知”。接下来,我们考虑各种简化及其基本的解释和动机。这些使我们取得了最新的结果,例如受到命中率(Herd Immunity Threshold;参见第7节),这是由Covid-19的爆发引起的。一个重要但有时隐含的流行模型成分是对具有一定特征的人与其他具有指定特定的人接触的率的规范
间充质干细胞在移植物与宿主间充质干细胞中的应用中的移植物与宿主疾病疾病移植物与宿主HAST
所有输出的干细胞移植都是许多疾病的有前途的治疗方法。只能显着增加死亡率和发病率的风险,这只能是治疗的并发症。GVHH是由供体细胞和宿主细胞免疫细胞之间不适当的免疫反应引起的。尽管存在预防性治疗,但仍可以看到GVHH,并且对常规治疗的抵抗力揭示了需要进行新的治疗研究的必要性。间充质干细胞(MKH),自我生产,与不同组织细胞的分化,低免疫原性特性,可以从各种组织中获得。他们承诺,由于免疫调节,免疫调节,免疫抑制和组织再生特性,炎症,免疫介导的退化性疾病的希望。在GVHH中,MKHS,旁分泌活性和纳米管,
病毒宿主接口:新型抗病毒目标的宝库
“对于当前的大流行反应,以及未来的大流行……。科学界必须准备好易于自我管理的药物的武器库,这些药物可以在鉴定出病毒剂后立即在快速,有效的临床试验中进行测试。”
跨动物微生物组的宿主遗传决定因素
动物在其胃酸睾丸区内具有多种微生物群落。系统发育关系,饮食,肠道形态,宿主生理学和生态学都影响动物进化枝内和之间的微生物组组成。新兴的证据指出了宿主遗传学,同时在确定物种内的肠道微生物组成方面也发挥了作用。在这里,我们讨论了各种动物物种微生物组遗传力的最新进展。候选基因和基于发现的研究 - 小鼠,果蝇,Caenorhabditis秀丽隐杆线虫,牛,猪,家禽和狒狒揭示了可遗传的微生物类型的趋势,以及与塑造微生物组相关的宿主基因和途径。可遗传的肠道微生物在宿主物种中往往受到系统发育的限制。免疫和生长相关基因中的宿主遗传变异驱动肠内这些可遗传的细菌的丰富性。迄今为止,只有一小片生命之树的后生分支,这是一个有机会散发出寄宿机制的机制,这是一个领域。
LI金属宿主的新兴梯度设计的进步
开发的宿主已被认为是绕过Li Metal Anode(LMA)的固有缺陷的潜在对策,例如不受控制的树突生长,不稳定的固体电解质界面和无限体积的流量。要实现适当的LI住宿,尤其是LI金属的自下而上的沉积,近年来寄主材料的梯度设计,包括岩石生物性和/或电导率引起了很多关注。但是,仍然没有对这个快速发展的主题进行的关键和专门评论。在这篇综述中,我们试图全面总结和更新指导LI成核和沉积方面的相关进展。首先,讨论了有关LI沉积的基本原理,特别关注宿主材料的梯度设计原理。相应地,系统地审查了岩石性,电导率及其混合动力的方面的进展。最后,提供了对高级主机对实用LMA的梯度设计的未来挑战和观点,这将为未来的研究提供有用的指导。
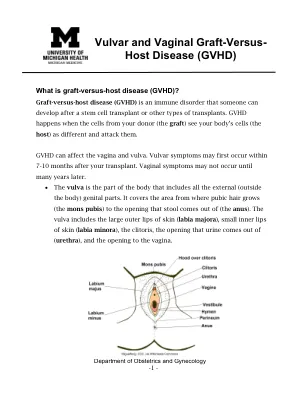
外阴和阴道移植抗宿主病(GVHD)
免责声明:本文档包含密歇根大学(U-M)健康为典型患者开发的信息和/或教学材料。它可能包含指向U-M Health并未创建的在线内容的链接,并且U-M Health不承担责任。它不能取代您的医疗保健提供者的医疗建议,因为您的经验可能与典型患者的经验不同。如果您对本文档,状况或治疗计划有任何疑问,请与您的医疗保健提供者交谈。
儿童和年轻人的移植物与宿主病(GVHD)
您的医生可能建议体外光遗化(ECP)治疗。如果药物的组合不起作用,或者不可能减少类固醇剂量,这可能会成为一种选择。ECP可以与其他免疫抑制治疗结合使用,如果有效,可以降低类固醇剂量。使用机器,通过您/您的孩子的中央线吸收一些血液。机器将其分为红细胞和白色细胞。机器用紫外线将白细胞处理白细胞,然后将所有血液(包括处理过的白细胞)通过中央线回归。
全球对宿主,水生和土壤微生物组的调查
。cc-by-nc-nd 4.0国际许可证(未经同行评审证明)获得的是作者/资助者,他授予Biorxiv授予Biorxiv的许可,以永久显示预印本。这是此预印本版本的版权持有人,该版本发布于2024年2月14日。 https://doi.org/10.1101/2022.11.15.515575 doi:Biorxiv Preprint
宿主限制因子 APOBEC3 在人类病毒基因组上的足迹
APOBEC3 酶是先天免疫效应物,可将突变引入病毒基因组。这些酶是胞嘧啶脱氨酶,可将胞嘧啶转化为尿嘧啶。它们优先突变胞嘧啶,然后突变胸腺嘧啶,使 5'TC 基序成为它们的首选目标。病毒已经进化出不同的策略来逃避 APOBEC3 的限制。某些病毒会主动编码对抗 APOBEC3 的病毒蛋白,而另一些病毒则会被动面对 APOBEC3 的选择压力,因为 APOBEC3 靶向基序的基因组已经耗尽。因此,APOBEC3 在某些病毒的基因组上留下了进化的足迹。我们研究的目的是识别这些具有由 APOBEC3 塑造的基因组的病毒。我们分析了 33,400 种人类病毒的基因组,以了解 APO-BEC3 青睐的基序是否耗尽。我们证明 APOBEC3 选择压力影响至少 22% 的目前已注释的所有人类病毒物种。乳头瘤病毒科和多瘤病毒科是足迹最密集的家族;证明选择压力作用于全基因组和两条链。细小病毒科成员在足迹的大小和定位方面具有不同的目标。有趣的是,B19 红细小病毒的两条链上都存在大量 APOBEC3 足迹;这使得该病毒基因组成为 APOBEC3 青睐基序最干净的序列之一。我们还发现地方性冠状病毒科具有显著的足迹。有趣的是,在人畜共患的 MERS-CoV、SARS-CoV-1 和 SARS-CoV-2 冠状病毒上未检测到这样的足迹。除了全基因组足迹的病毒外,某些病毒仅在其基因组的很短部分上留下足迹。这种情况对于γ-疱疹病毒科和腺病毒科来说就是如此,它们的足迹位于裂解性复制起点上。在逆转录的 HIV- 1、HIV-2、HTLV-1 和 HBV 病毒的负链上也可以检测到轻微的足迹。总之,我们的数据说明了 APOBEC3 对人类病毒的选择压力程度,并确定了新的假定 APOBEC3 靶向病毒。
气候变化对不完美的主宿主运动生态学的影响
表1:确定巨大食肉动物活性受气温控制的程度的模型选择结果。最佳拟合模型是通过校正小样本量(AICC)的Akaike的信息标准来识别的。所有模型均包含围绕单个巨型武术的随机截距。参数值显示在logit量表上。