XiaoMi-AI文件搜索系统
World File Search System血管正常化:重塑卵巢癌的肿瘤微环境并增强抗肿瘤免疫力
卵巢癌仍然是一种具有挑战性的疾病,治疗方法有限,预后不良。肿瘤微环境 (TME) 在肿瘤生长、进展和治疗反应中起着至关重要的作用。TME 的一个特征是异常的肿瘤血管,这与血液灌注不足、缺氧和免疫逃逸有关。血管正常化是一种旨在纠正异常肿瘤血管的治疗策略,它已成为重塑 TME、增强抗肿瘤免疫力和与卵巢癌免疫治疗协同作用的一种有前途的方法。这篇综述文章全面概述了血管正常化及其在卵巢癌中的潜在影响。在这篇综述中,我们总结了抗血管生成和免疫调节之间复杂的相互作用,以及 ICI 联合抗血管生成治疗在卵巢癌中的应用。本综述中讨论的令人信服的证据有助于不断增长的知识体系支持使用联合疗法作为卵巢癌有希望的治疗模式,为进一步的临床开发和优化这种治疗方法铺平了道路。
针对机械性微环境和肝癌干细胞:肝癌的有前途的治疗策略
摘要在过去的20年中,癌症干细胞(CSC)已被确定为癌症发生,进展,化学降低,复发和转移的根本原因。靶向CSC是癌症管理和治疗的新型治疗策略。肝癌(LC)是一种恶性疾病,可能危害人类健康。研究越来越多地表明,肝机械微环境的变化是触发肝癌的发生和发展的主要驱动因素。在这篇综述中,我们总结了对肝脏癌症中肝机械 - 微环境和肝癌干细胞(LCSC)在肝癌进展中的作用的最新理解。我们还讨论了肝癌组织的机械异质性与LCSC募集和转移之间的关系。最后,我们强调了LCSC中潜在的机械敏感分子和肝癌的机械疗法。了解机械环境和LCSC的作用和调节机制可能会提供对肝癌进展的基本见解,并有助于进一步发展新型治疗策略。关键词肝癌;机械 - 微环境;癌干细胞;肿瘤异质性;机械疗法
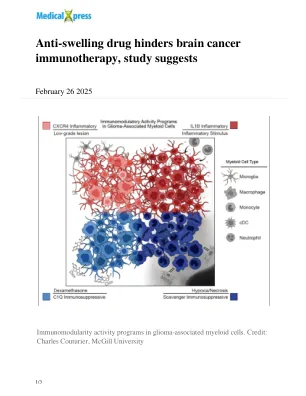
改变肿瘤微环境可能会减少白血病免疫疗法后的复发
值得注意的是,他们在肿瘤中发现了两种类型的免疫抑制性髓样细胞:一种与死组织区域相关,另一种与抗网疗疗法有关。在被给予地塞米松的患者中,这些细胞的免疫抑制作用明显高于未患者,并且随着剂量增加的效果,其影响更强。
通过合并的CGAS刺途径策略靶向重塑肿瘤微环境
免疫检查点抑制剂(ICI)代表了治疗恶性肿瘤(例如黑色素瘤和非小细胞肺癌)的开创性进步,展示了实质性的治疗作用。尽管如此,ICI的效率仅限于一小部分患者,主要使患有“热”肿瘤的患者受益,其特征是具有明显的免疫性效果。将“冷”肿瘤转化为最少的免疫活性的挑战,以增强其对ICIS的反应性,是当前研究的关键而复杂的领域。这项努力的中心是CGAS刺途径的激活,CGAS刺激途径是先天性和适应性免疫之间的关键联系。该途径的激活促进了I型干扰素(IFN)的产生和CD8 +
肿瘤微环境反应和癌症治疗抵抗的单细胞解剖
多年来,癌症治疗策略发生了重大变化,其中化疗、靶向治疗和免疫治疗是主要支柱。每种治疗方式都通过与肿瘤微环境 (TME) 相互作用产生独特的治疗结果,而肿瘤微环境对癌症进展施加了根本的选择压力。单细胞分析技术的出现以前所未有的分辨率彻底改变了我们对 TME 复杂和异质性质的理解。本综述深入探讨了癌症疗法如何重塑不同癌症类型微环境的共性和差异表现。我们重点介绍了突破性的免疫检查点阻断 (ICB) 策略单独使用或与肿瘤靶向治疗相结合在单细胞水平上解码时如何获得全面的机制见解,旨在推动未来个性化治疗的研究方向。
肿瘤微环境响应肽基超分子药物递送系统
肿瘤组织和正常组织之间的物理和生化差异提供了有希望的触发因素,可用于设计用于癌症治疗的刺激响应性药物递送平台。合理设计的基于肽的超分子结构可以通过响应肿瘤微环境进行结构转换并实现抗肿瘤药物的控制释放。这篇小型综述总结了使用基于肽的材料设计内部触发响应性药物递送平台的最新方法。着重介绍了在酸性 pH、高温、高氧化电位和肿瘤组织中过表达的蛋白质下表现出刺激响应性结构转换的肽组装体。我们还讨论了当前基于肽的超分子递送平台对抗癌症的挑战。
细胞表面映射通过免疫细胞上的 Dexter 能量转移进行微环境映射
通过阐明局部生物分子网络或微环境,可以了解许多疾病病理。为此,酶促邻近标记平台被广泛应用于绘制亚细胞结构中更广泛的空间关系。然而,人们长期以来一直在寻求能够更高精度地绘制微环境的技术。在这里,我们描述了一个微环境映射平台,该平台利用光催化卡宾生成来选择性地识别细胞膜上的蛋白质-蛋白质相互作用,我们将这种方法称为 MicroMap(m Map)。通过使用光催化剂-抗体偶联物在空间上定位卡宾生成,我们展示了对抗体结合靶标及其微环境蛋白质邻居的选择性标记。该技术识别了活淋巴细胞中程序性死亡配体 1 (PD-L1) 微环境的组成蛋白,并在免疫突触连接内进行选择性标记。
RCC免疫微环境在有针对性的治疗之后:朋友还是敌人?
肾细胞癌(RCC)由具有不同分子和组织学肿瘤异质性的不同亚型组成。尽管各种靶向疗法的出现在过去15年(自2006年以来)改善了晚期RCC患者的存活率,但由于耐药性,很少有病例经历了完全反应。最近的研究表明,靶向疗法后的结果可能与肿瘤微环境(TME)中免疫反应和抑制器之间的复杂交联有关。此外,药物研发的进展增强了我们对免疫疗法和联合治疗的认识和理解。在本评论文章中,我们打算全面摘要有关TME及其在靶向疗法后的改变,在这方面提供有效的证据,并讨论针对性疗法和免疫疗法之间的最佳匹配。
高尔基蛋白 73:免疫和肿瘤微环境中炎症的驱动因素
Error 500 (Server Error)!!1500.That’s an error.There was an error. Please try again later.That’s all we know.
利用血小板进行抗肿瘤药物输送和调节肿瘤免疫微环境
血小板是血液成分,传统上认为在血管止血和血栓形成中起着重要作用。近年来,血小板因其在肿瘤发生和发展中的作用而受到新的关注。一方面,血小板被各种肿瘤主动招募,是肿瘤微环境 (TME) 的重要组成部分,从而激发了血小板用于肿瘤靶向药物输送的用途。为此,已经提出了各种基于血小板的装置,例如天然血小板、工程血小板、血小板膜和血小板衍生的微粒。另一方面,血小板通过引导和/或协助各种肿瘤相关免疫细胞参与肿瘤免疫抑制机制。然而,在炎症和自身免疫性疾病的背景下,血小板可以通过促进免疫细胞动员和活化来增强免疫反应,从而加剧组织损伤。因此,人们对使用肿瘤相关血小板作为治疗调节 TME 和增强抗肿瘤免疫反应的靶点的兴趣日益浓厚。在这篇综述中,我们总结了利用血小板进行抗肿瘤药物输送和TME免疫调节的最新进展。