XiaoMi-AI文件搜索系统
World File Search System2025; 15(8):3532-3550。 doi:10.7150/thno.103809研究论文M6A SOX18的修饰导致
理由:败血症诱导的心肌病(SIC)是一种迅速发展的疾病,在没有有效的治疗干预的情况下预后不良。心肌细胞凋亡是导致SIC心脏功能障碍的关键因素。目前,对此机制的研究尚不清楚。方法:我们进行了LPS诱导的原代小鼠心肌模型和小鼠SIC建模。通过mRNA-Seq,我们发现SIC小鼠心脏组织中明显的凋亡。 进一步的共聚焦显微镜和免疫沉淀结果证实,PTX3是心肌细胞凋亡的重要参与者。 然后,我们使用芯片和双酸酶报告基因测定法确认SOX18对PTX3产生转录抑制作用。 M6A-SEQ和RNA稳定性测定确认,RBM15/YTHDF2介导/识别的M6A修饰是SIC中Sox18变化的关键因素。 结果:我们的实验表明,SIC中异常升高的PTX3在介导流体吞噬作用中起关键作用。 在生理条件下,PTX3转录被SOX18抑制。 然而,在败血性心肌病期间,SOX18稳定性受到RBM15/YTHDF2介导的M6A修饰的损害,从而导致PTX3水平升高,并随后诱导心肌细胞凋亡。 结论:总而言之,我们已经描述了SIC中的RBM15/YTHDF2-SOX18-PTX3轴。 它为SIC中心肌细胞凋亡的治疗提供了一种新方法,以改善预后。通过mRNA-Seq,我们发现SIC小鼠心脏组织中明显的凋亡。进一步的共聚焦显微镜和免疫沉淀结果证实,PTX3是心肌细胞凋亡的重要参与者。然后,我们使用芯片和双酸酶报告基因测定法确认SOX18对PTX3产生转录抑制作用。M6A-SEQ和RNA稳定性测定确认,RBM15/YTHDF2介导/识别的M6A修饰是SIC中Sox18变化的关键因素。结果:我们的实验表明,SIC中异常升高的PTX3在介导流体吞噬作用中起关键作用。在生理条件下,PTX3转录被SOX18抑制。然而,在败血性心肌病期间,SOX18稳定性受到RBM15/YTHDF2介导的M6A修饰的损害,从而导致PTX3水平升高,并随后诱导心肌细胞凋亡。结论:总而言之,我们已经描述了SIC中的RBM15/YTHDF2-SOX18-PTX3轴。它为SIC中心肌细胞凋亡的治疗提供了一种新方法,以改善预后。
公司演示
人类IPSC衍生的心肌细胞贴片是患有严重心脏衰竭患者的再生疗法。这些患者尝试了所有可用的内科医学,结果有限。我们的产品针对这些患者。这些斑块是由IPSC细胞分化为大规模心肌cosete的,并使用我们的专有技术以斑块形式创建它们的。通过大阪大学未来医学科学系(SAWA博士)和京都大学的IPSC研究所(Yamanaka教授)的联合研究,我们试图将这些产品商业化。 将这些斑块放在患有缺血的心脏表面上,从这些斑块释放出大量的细胞因子供应到心肌。 这些细胞因子将改善血液循环,因此心脏功能将恢复。 此外,斑块中包含的心肌细胞将与患者的心肌同时扩展和收缩,并有助于恢复心脏功能。通过大阪大学未来医学科学系(SAWA博士)和京都大学的IPSC研究所(Yamanaka教授)的联合研究,我们试图将这些产品商业化。将这些斑块放在患有缺血的心脏表面上,从这些斑块释放出大量的细胞因子供应到心肌。这些细胞因子将改善血液循环,因此心脏功能将恢复。此外,斑块中包含的心肌细胞将与患者的心肌同时扩展和收缩,并有助于恢复心脏功能。
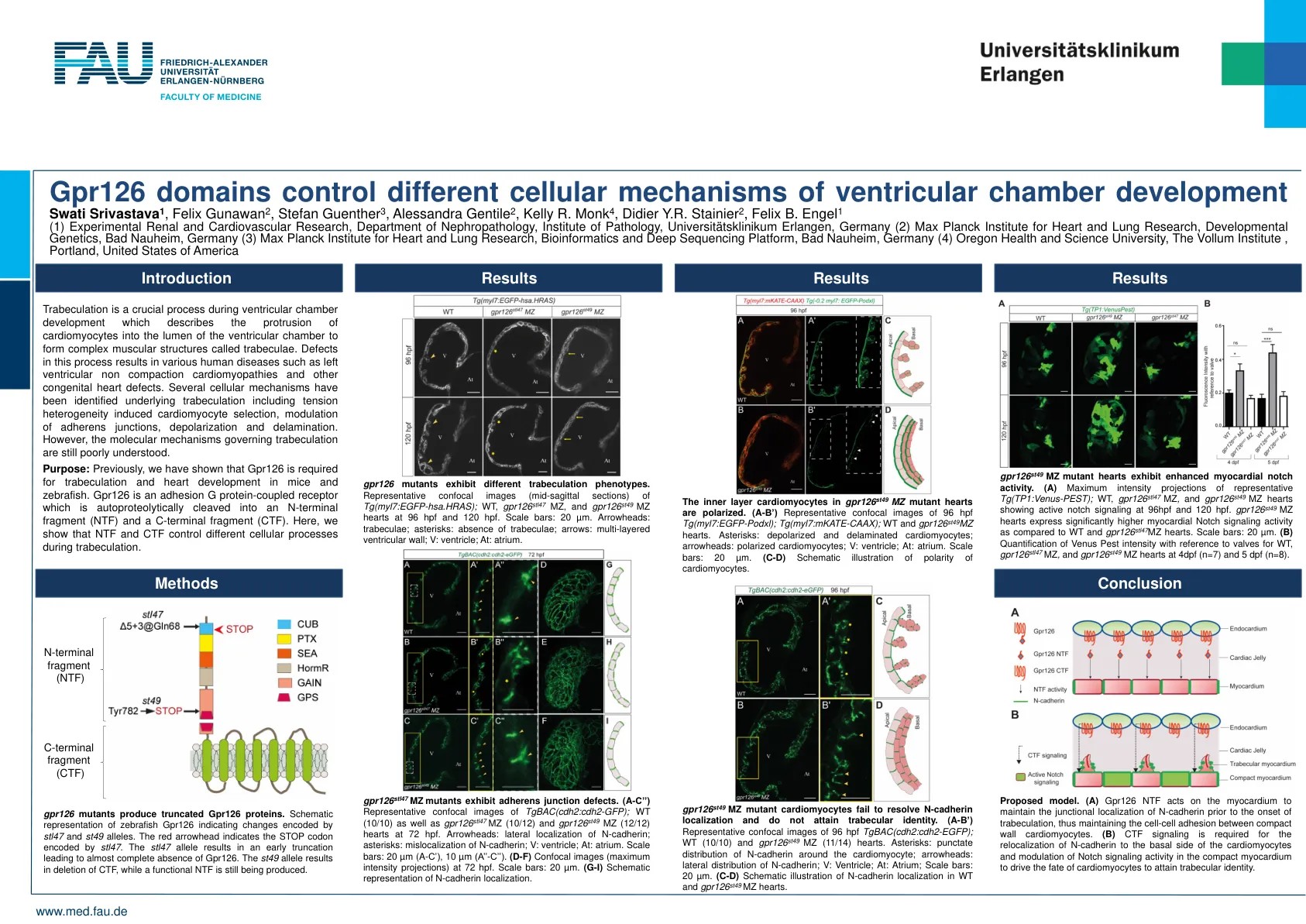
Gpr126 结构域控制心室发育的不同细胞机制 Swati Srivastava 1、Felix Gunawan 2、Stefan Guenther 3、Ale
小梁形成是心室发育过程中的一个关键过程,它描述了心肌细胞突出到心室腔内形成称为小梁的复杂肌肉结构。该过程中的缺陷会导致各种人类疾病,例如左心室非致密化性心肌病和其他先天性心脏缺陷。已经确定了小梁形成的几种细胞机制,包括张力异质性诱导的心肌细胞选择、粘附连接的调节、去极化和分层。然而,控制小梁形成的分子机制仍然不太清楚。目的:之前,我们已经证明 Gpr126 是小鼠和斑马鱼小梁形成和心脏发育所必需的。Gpr126 是一种粘附 G 蛋白偶联受体,可自蛋白酶切为 N 端片段 (NTF) 和 C 端片段 (CTF)。在这里,我们表明 NTF 和 CTF 在小梁形成过程中控制不同的细胞过程。
反义寡核苷酸调节与SCN1A相关的Dravet综合征中毒药外显子的异常包含
摘要:随着发现诱导的多能干细胞(IPSC),现在可以从无限的体细胞来源产生多种细胞类型,包括IPSC衍生的心肌细胞(IPSC-CM)。这些IPSC-CM用于不同目的,例如疾病建模,药物发现,心脏毒性测试和个性化医学。2D IPSC-CM模型已显示出令人鼓舞的结果,但与体内成人心肌细胞相比,它们更不成熟。新颖的方法创建3D模型,并可能正在开发其他(心脏)细胞类型。这不仅会改善细胞的成熟度,而且还会导致更与人心脏更相似的生理相关模型。在这篇综述中,我们着重于2D和3D中遗传性心律不齐的建模以及这些模型在治疗开发和药物测试中的使用。
小分子诱导的ERBB4激活以治疗心力衰竭
心力衰竭是一种常见的致命疾病,需要新的治疗方法。Neuregulin-1(NRG1)/红细胞性白血病病毒癌基因同源物4(ERBB4)途径是一个有趣的靶标,因为其心脏保护作用。重组NRG1的治疗用途很困难,因为它需要静脉内给药,并且对ERBB4受体是非选择性的。此外,通常认为受体二聚体的小分子激动剂的发展是具有挑战性的。在这里,我们假设小分子诱导的ERBB4激活是可行的,可以预防心肌细胞死亡和纤维化。为此,我们筛选了10,240种化合物,以诱导ERBB4均二聚化的能力。我们鉴定了一系列的8种结构相似化合物(称为EF-1 - EF-8),该化合物浓度依赖于诱导的ERBB4二聚体,而EF-1是最有效的。ef-1在培养的心肌细胞和培养的人类心脏成纤维细胞中培养的心肌细胞和胶原蛋白产生中的ERBB4依赖性方式和肥大降低。ef-1还抑制了血管紧张素II(AngII)诱导的野生型小鼠的心肌纤维化,但在ERBB4-NULL小鼠中却没有。此外,在用阿霉素(DOX)治疗的野生型小鼠中,EF-1降低了肌钙蛋白释放,但在ERBB4-NULL小鼠中却没有。最后,EF-1改善了心肌梗塞小鼠模型(MI)的心脏功能。总而言之,我们表明,小分子诱导的ERBB4激活是可能的,在心脏中显示抗纤维化和心肌细胞保护作用。这项研究可能是开发小分子ERBB4激动剂作为治疗心力衰竭的新型药物的开始。
使用来自诱导性多能干细胞的人类心肌细胞对 CACNB2 变异型布鲁格达综合征进行临床前研究
1 德国海德堡大学曼海姆大学医学中心(UMM)医学院第一医学系,邮编 68167 曼海姆;rujia.zhong@medma.uni-heidelberg.de (RZ);schimanski.t@gmail.com (TS);feng.zhang@medma.uni-heidelberg.de (FZ);huan.lan@medma.uni-heidelberg.de 或 lh6402196@126.com (HL);alyssa.hohn@web.de (AH);qiang.xu@medma.uni-heidelberg.de (QX);mengying.huang@medma.uni-heidelberg.de (MH);zhenxing.liao@medma.uni-heidelberg.de (ZL);lin.qiao@medma.uni-heidelberg.de (LQ); zhen.yang@medma.uni-heidelberg.de (ZY); yingrui.li@medma.uni-heidelberg.de (YL); zhihan.zhao@medma.uni-heidelberg.de (ZZ); xin.li@medma.uni-heidelberg.de (XL); roselena1996@gmail.com (LR); sebastian9876@googlemail.com (SA); lasse-maywald@web.de (LM); jonasnelsonmueller@googlemail.com (JM); hendrik.dinkel@yahoo.de (HD); yannick.xi@medma.uni-heidelberg.de (YX); siegfried.lang@umm.de (SL); ibrahim.akin@umm.de (IA) 2 DZHK(德国心血管研究中心),合作伙伴网站,68167 曼海姆,德国; narasimha.swamy@mdc-berlin.de (NS); mandy.kleinsorge@gwdg.de (MK); sebastian.dieck@mdc-berlin.de (SD); lukas.cyganek@gwdg.de (LC) 3 西南医科大学心血管研究所,教育部医学电生理重点实验室,四川省医学电生理重点实验室,泸州 646000,中国 4 苏黎世大学心脏中心心脏病学系,Rämistrasse 100,8091 苏黎世,瑞士;ardan.saguner@usz.ch (AS); first.duru@usz.ch (FD) 5 海德堡大学人类遗传学研究所人类遗传学系,69120 海德堡,德国; johannes.jannsen@uni-heidelberg.de 6 马克斯·德尔布吕克分子医学中心,13125 柏林,德国 7 哥廷根大学医学中心心脏病学和肺病学诊所干细胞科,37075 哥廷根,德国 8 波鸿鲁尔大学贝格曼希尔大学医院,44789 波鸿,德国;ibrahim.elbattrawy2006@gmail.com * 通讯地址:xiaobo.zhou@medma.uni-heidelberg.de;电话:+49-621-383-1448;传真:+49-621-383-1474 † 这些作者对本文的贡献相同。‡ 这些作者为高级作者。
心肌细胞机械记忆通过talin Interactome和DLC1的依赖性调节RhoA糖瘤物种中的胞质线性DNA质粒
。cc-by-nc-nd 4.0国际许可证(未获得同行评审证书)获得的是作者/资助者,他已授予Biorxiv授予Biorxiv的许可,以永久显示预印本。这是该版本的版权所有,该版本发布于2023年7月20日。 https://doi.org/10.1101/2023.07.20.549855 doi:Biorxiv Preprint
与干细胞小裂相关的生物标志物在人类三尖瓣底部的表达
干细胞壁ches已在更高再生能力的组织中进行了彻底研究,但在细胞更新缓慢(例如人心脏)的组织中没有进行彻底研究。左心室连接(AVJ)是二尖瓣的底部,以前已被提议作为成年人类心脏心脏祖细胞的利基区域。在本研究中,我们探索了人心的右侧,即三尖瓣的基础,以研究该地区作为祖细胞生态位的潜力。来自外植的人类心脏的成对活检是从多器官供体中收集的(n = 12)。使用RNA测序比较了AVJ,右心房(RA)和右心室(RV)的侧面表达与干细胞小裂相关的生物标志物的表达。基因表达数据表明与拟议小裂区(即AVJ)中与胚胎发育和细胞外基质(ECM)组成相关的基因上调。此外,免疫组织化学在同一区域内显示出胎儿心脏标志物MDR1,SSEA4和WT1的高表达。检测到HIF1 A的核表达表明缺氧。 稀有细胞是通过与心肌细胞核标记PCM1和心脏肌钙蛋白T(CTNT)的增殖标记PCNA和Ki67共同染色的,表明小心肌细胞的增殖。 还发现了 WT1 + / CTNT +和SSEA4 + / CTNT +细胞,表明心肌细胞特异性祖细胞。 随着距三尖瓣距离的距离,干细胞标记的表达逐渐减小。 在RV组织中未观察到这些标记的表达。检测到HIF1 A的核表达表明缺氧。稀有细胞是通过与心肌细胞核标记PCM1和心脏肌钙蛋白T(CTNT)的增殖标记PCNA和Ki67共同染色的,表明小心肌细胞的增殖。WT1 + / CTNT +和SSEA4 + / CTNT +细胞,表明心肌细胞特异性祖细胞。随着距三尖瓣距离的距离,干细胞标记的表达逐渐减小。在RV组织中未观察到这些标记的表达。总而言之,三尖瓣的底部是一个富含ECM的区域,该区域含有具有几个干细胞小裂相关标记的细胞。干细胞标记与CTNT的共表达表示心肌细胞特异性祖细胞。我们以前报道了二尖瓣板底部的类似数据,因此提出人类的成年心肌细胞祖细胞位于两个室内瓣膜周围。
针对患者衍生的心脏起搏器细胞的最新分化协议
摘要:人类诱导的多能干细胞(HIPSC)衍生的心肌细胞提高了从广泛的人类疾病中产生多能干细胞的可能性。在心脏病学领域中,HIPSC已被用来解决原发性心律不齐的机械基础和对药物安全的研究。这些研究主要集中在心房和心室病理上。顺便说一句,已经开发出许多基于HIPSC的心脏分化方案来区分心房或心室样的心肌细胞。很少有方案成功地提出了获得HIPSC衍生的心脏起搏器细胞的方法,尽管从窦淋巴结中的人体组织的可用性非常有限。在进一步了解我们对窦淋巴结病理生理学基础机制和测试针对Sinoatrial节点功能障碍的创新临床策略方面,提供类似起搏器样细胞的体外来源至关重要(即生物学改进者和基于遗传学和药理学的治疗)。在这里,我们总结并详细介绍了目前可用的方案,用于获得患者来源的起搏器样细胞。
心脏基因疗法治疗糖尿病心肌病并降低血糖
引言目前有4.51亿人在全球诊断出患有糖尿病,其中90%的人患有2型糖尿病(T2DM),心力衰竭是最常见的心血管并发症(1)。影响了超过三分之一的糖尿病患者,糖尿病心肌病是心力衰竭和心脏过早死亡的日益增长的原因(1)。此外,大多数患有糖尿病心肌病的患者的症状表现为心力衰竭,并具有保留的射血分数(HFPEF),并且该人群的诊断工具和治疗选择更加有限(2,3)。迫切需要进一步了解与T2DM相关的糖尿病性心肌病和HFPEF的病理生理,以便实现更典型和有针对性的临床方法。已知的糖尿病失败心肌的致病性和潜在的靶向机制包括胰岛素代谢信号传导受损,细胞内钙失调,线粒体功能障碍和氧化应激(4)。在非糖尿病性失败的心肌细胞中,通过心脏桥接整合器1(CBIN1)(5)组织的trans-Perse-Pubules(T-pubules)的钙处理微域(6,7)。这些微区域用作局部运输和信号枢纽,可用于健康的心肌细胞中的钙偏转钙的发育和舒张钙的去除(5、8、9)。微域的破坏,如心力衰竭时,会导致钙瞬变和舒张钙过载弱(6,9-11)。在失败的心肌细胞中改变的CBIN1-微分类域也可以通过血浆样品(13)通过CBIN1评分(CS)(14)来测量,这是心肌重塑的指数。在非糖尿病性心力衰竭的人类和动物模型中,心肌CBIN1在转录下调(7、9、12),具有受损的T-pubule微域结构,以及CBIN1-MICRODOMAIN的恢复钙循环和心脏功能(6,7)。然而,尚不清楚微型域是否会在患有糖尿病心肌病的心肌细胞中破坏。在糖尿病心脏中,除了舒张性钙失调外,胰岛素抵抗会损害葡萄糖转运蛋白4(Glut4)的表面表达降低引起的葡萄糖摄取(GLUT4)(15,16)。t小管被已知