XiaoMi-AI文件搜索系统
World File Search System受体酪氨酸激酶样孤儿受体 1 抑制剂 strictinin 对高度侵袭性的雄激素非依赖性前列腺癌表现出抗癌特性
neg -AI DU145 细胞中,strictinin 抑制 ROR1 表达并调节下游 AKT-GSK3β 信号传导。此外,strictinin 在 DU145 细胞中表现出抗迁移、抗侵袭但促凋亡作用最小,这可能是因为 DU145 与 PC3 细胞相比 ROR1 表达较少。在整个研究过程中,strictinin 对正常前列腺上皮细胞 RWPE-1 的表型影响最小(IC 50 为 658.5 µmol/L)。进一步确定 Strictinin 与多西他赛具有协同作用 [联合指数 (CI) = 0.311],发现联合治疗将 PC3 细胞中 strictinin 的 IC 50 降低至 38.71 µmol/L。结论:ROR1 是一种可用于治疗前列腺癌的新兴分子靶点。本研究的数据证实 strictinin 是一种靶向 AR 的潜在治疗剂
重力,磁性和磁性前景
本研究利用磁性,重力和磁铁(MT)数据,对伊朗的Sabalan地热区进行了全面的地球物理研究。这些数据已倒入5000米的深度。磁数据反演准确识别出断层或断裂。重力数据反演产生了一个密度模型,以区分侵入性质量,储层和覆盖单元。mt数据反演使用了TM和TE模式的明显电阻率和相位数据。将所得模型与地质横截面进行了比较,以评估其准确性和一致性。地球物理模型的整合为萨巴兰地区提供了全面的地质概念模型。鉴定了热源,热液储存库和潜在的地热流体途径,证明地球物理方法在地下映射中的有效性。基于钻探和地质数据的较新的Sabalan模型的一致性增加了对发现的信心。
他拉唑帕尼联合恩杂鲁胺治疗一线转移性去势抵抗性前列腺癌 (TALAPRO-2):一项随机、安慰剂对照的 3 期试验
临床前研究表明 AR 信号通路与同源修复之间存在密切的联系。因此,AR 的抑制(例如 NHA 抑制)似乎会导致 DNA 双链修复中断,就像受影响的修复基因本身的致病性变化一样。基于这一假设,设计了三项 3 期研究:奥拉帕尼和醋酸阿比特龙/泼尼松 (AAP) 的 PROPEL 研究、他拉佐帕尼和恩杂鲁胺的 TALAPRO-2 研究以及尼拉帕尼和 AAP 的 MAGNITUDE 研究。与 PARP 抑制剂单一疗法的研究不同,无论是否存在 HRR 缺陷,都可以纳入上述研究。然而,在 MAGNITUDE 研究中,测试和分配研究队列是在随机分组之前进行的。然后,中期分析因联合治疗活性不足而导致单独考虑的 HRR 阴性患者的募集过早停止。
r e v i e w机械洞察到局部到转移性前列腺癌转变和治疗机会
摘要:前列腺癌是美国男性中最常见的非乳腺癌。多种机制参与肿瘤发生和向转移的发展。虽然雄激素剥夺疗法仍然是治疗的基石,但不可避免的是对cast割疾病的进展。由于PTEN损失,上皮 - 腔内的MAL过渡途径,同源重组修复以及抗DNA修复途径的机制,PI3K/AKT的异常途径激活,导致转移性castatation抗性耐药的前列腺癌的治疗靶向的机会。本综述着重于进展的机制和关键试验,以评估利用这些途径的药物和组合。关键词:前列腺癌,转移,castration抗性前列腺癌,上皮间质转变,雄激素受体途径抑制剂,多ADP核糖ribose途径抑制剂
DNA损伤反应和不匹配修复基因缺陷在晚期和转移性前列腺癌
摘要:多达25%的晚期前列腺癌(PCA)中存在DNA损伤反应(DDR)和相关基因的改变。最常改变的基因参与同源重组修复,fanconi贫血和不匹配修复途径,并且它们的降低导致DDR-DEDE的表型的高度异构谱。这些改变的一半以上涉及非BRCA DDR基因。从治疗性的角度来看,多ADP-核糖聚合酶抑制剂在具有BRCA2和BRCA1改变的肿瘤中具有强大的临床效率。不匹配修复 - 具有较高的PCA和CDK12降低的PCA子集,容易受到免疫检查点抑制剂的影响。新兴数据指向具有ATM降低的PCA中ATR抑制剂的效率。仍然,对于大多数非BRCA DDR改变,没有足够的治疗意义明确,并且尚未确定成功的靶向治疗选择。
种系DNA修复基因和HOXB13转移性前列腺癌男性的突变:来自大韩国队列的数据
目的:目的:诸如BRCA2之类的DNA损伤修复(DDR)基因中的种系突变与前列腺癌(PC)风险有关,但尚未对亚洲男性的转移性前列腺癌(MPC)进行彻底评估。这项研究试图评估最大的韩国人队列中DDR突变的频率。材料和方法:材料和方法:我们招募了340例未针对癌症家族史的MPC患者,并与495例对照相比。全基因组测序被用于评估26个DDR基因和HOXB13中的种系致病/可能的致病变异(PV/LPV),包括7个基因(ATT,BRCA1/2,CHEK2,BRIP1,PALB2和NBN)与遗传性PC相关。进行了与已发表的高加索人和日本同伙的比较。结果:结果:在30名(8.8%)患者中确定了总共28个PV/LPV;在13个基因中发现了突变,包括BRCA2(15名男性[4.41%]),ATM(2人[0.59%]),NBN(2名男性[0.59%]和BRIP1(2个人[0.59%])。只有一名患者患有HOXB13突变(0.29%)。与高加索人相比,在韩国MPC中观察到总体种系变异频率较低(8.8%vs。11.8%),但是个体变体与白种人和地理上类似的日本同伙有明显不同。PV/ LPV倾向于随着Gleason评分较高(GS 7,7.1%; GS 8,7.5%; GS 9-10,9.9%)。结论:结论:BRCA2是支持其重要性的不同人群共有的最常见的基因,但在韩国MPC中的变异分布方面有所不同,强调了对种族特异性遗传模型的需求。未来的特定民族分析是有必要的,以验证我们的发现。
激素敏感性前列腺癌 (HSPC) 的治疗
泌尿科护理基金会是世界领先的泌尿科基金会,也是美国泌尿科协会的官方基金会。我们为那些积极管理泌尿科健康的人和那些准备改变健康的人提供信息。我们的信息基于美国泌尿科协会的资源,并由医学专家审核。要了解更多信息,请访问泌尿科护理基金会的网站 UrologyHealth.org/UrologicConditions 或访问 UrologyHealth.org/FindAUrologist 查找您附近的医生。
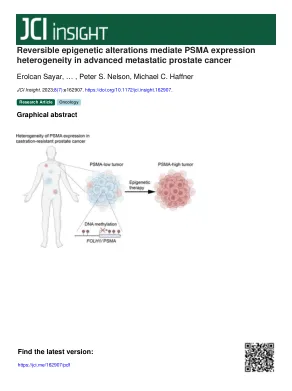
可逆性表观遗传改变介导晚期转移性前列腺癌中 PSMA 表达异质性
利益冲突:PSN 曾担任 Bristol Myers Squibb、Pfizer 和 Janssen 的付费顾问。LDT 是 Alpenglow biosciences 的联合创始人和股权持有者。NHB 是康奈尔大学抗 PSMA 抗体技术专利的发明人(可在 patentscope.wipo.int 找到所有专利的列表,搜索词:Neil H. Bander)。他是 Convergent Therapeutics Inc. 的创始人、董事和顾问,PSMA 抗体技术已授权给该公司。他还是 XenImmune Therapeutics Inc. 的创始人、董事和顾问。EC 获得了 AbbVie、Astra Zeneca、Foghorn、Kronos、MacroGenics、Bayer Pharmaceuticals、Forma Pharmaceuticals、Janssen Research、Gilead、Arvina 和 Zenith Epigenetics 的赞助研究资金。 MTS 是 Sanofi、AstraZeneca、PharmaIN 和 Resverlogix 的付费顾问/受聘者,并获得了 Zenith Epigenetics、Bristol Myers Squibb、Merck、Immunomedics、Janssen、AstraZeneca、Pfizer、Madison Vaccines、Hoffman-La Roche、Tmunity、SignalOne Bio 和 Ambrx Inc. 的研究资金。JEH 报告称,Seagen 支付了顾问费,Regeneron 和 Dendreon 向其所在机构支付了研究支持费。FYF 是 Artera、BlueStar Genomics 和 SerImmune 的科学顾问委员会成员,也是 Astellas、Bayer、Blue Earth Diagnostics、Foundation Medicine、Janssen、Myovant、Novartis 和 Roivant 的付费顾问。
使去势抵抗性前列腺癌重新对抗雄激素疗法敏感的策略
摘要:自从前列腺癌 (PCa) 被描述为雄激素依赖性癌症以来,雄激素受体 (AR) 就成为其全身治疗的主要手段:雄激素剥夺疗法 (ADT)。尽管近年来,已经引入了更有效的药物,但这种慢性 AR 信号抑制不可避免地导致肿瘤进入无法治愈的去势抵抗阶段。然而,在去势抵抗状态下,PCa 细胞仍然高度依赖于 AR 信号轴,证据是许多患有去势抵抗性前列腺癌 (CRPC) 的男性仍然对新一代 AR 信号抑制剂 (ARSis) 有反应。然而,这种反应在时间上是有限的,很快,肿瘤就会发展出适应性机制,使其再次对这些治疗没有反应。因此,研究人员专注于寻找控制这些无反应肿瘤的新替代方案,例如:(1) 具有不同作用机制的药物,(2) 增强协同作用的联合疗法,以及 (3) 使肿瘤对先前针对的靶点重新敏感的药物或策略。许多药物利用促进 CRPC 中 AR 信号持续或重新激活的各种机制,探索了最后一种有趣的行为。在本文中,我们将回顾那些能够通过使用“铰链”治疗使癌细胞对先前使用的治疗重新敏感的策略和药物,目的是获得肿瘤学益处。一些例子是:双极雄激素疗法 (BAT) 和药物,例如吲哚美辛、氯硝柳胺、拉帕替尼、帕比司他、氯米帕明、二甲双胍和反义寡核苷酸。除了对 PCa 的抑制作用外,所有这些药物都显示出克服 CRPC 中对抗雄激素药物的获得性耐药性的有益能力,使肿瘤细胞对先前使用的 ARSis 重新敏感。