XiaoMi-AI文件搜索系统
World File Search System基于比例抑制剂
这项工作旨在从静态和动态的角度评估在铁离子存在下基于聚羧酸的尺度抑制剂的性能(FE III)。分别根据NACE TM0197-2010和NACE TM31105-2005标准进行静态(JAR测试)和动态(管阻塞测试)测试。在油井的流动条件下确定最低抑制浓度(LIC)。此外,还评估了Fe III离子浓度对降水过程的影响。通过X射线衍射(XRD),红外光谱(FTIR)和扫描电子显微镜(SEM)分析量表沉积物。结果表明,在没有Fe III离子的情况下,尺度抑制剂在化学上与所选盐水具有30 mg L -1的lic含量。在Fe III离子的存在下,抑制剂被证明是效率低下且不兼容的,因此无法确定LIC。组合的XRD,FTIR和SEM分析使我们能够将抑制剂的作用机理识别为络合物之一,Poly(羧酸)-ca 2+。此外,在Fe III离子存在下进行的分析表明,Caco 3晶体的结尾形态发生了显着变化。此外,已经证明,Fe III离子显着影响抑制剂的性能。最后,结果表明,在没有高浓度的Fe III离子的情况下,聚(羧酸)尺度抑制剂可以是减轻因油井中无机尺度沉积而导致的运营成本的选择。
rNase抑制剂
蛋白质的特异性RNase源:带有猪RNase抑制剂基因的重组大肠杆菌菌株。单位定义:1个单位定义为抑制50%cytidine 2',3'-循环单磷酸的水解所需的酶量,由5 ng的RNase A(1)抑制。分子量:74,828 Daltons质量控制分析:使用2倍连续性稀释方法确定单位活动。在1x RNase抑制剂反应缓冲液中制成酶的稀释液,并添加到含有1mm胞苷2',3'-环磷酸1mm的1000 µL反应中,其中包含100mm tris-tris-tris-tris-trisate,1mm Edta,1mm Edta,pH 6.5的1X反应缓冲液中的1μgrNase A。在286nm处的吸光度。蛋白浓度(OD 280)由OD 280吸光度的物理纯度确定,通过浓缩和稀释的酶溶液的SDS-PAGE,然后是银色染色检测。通过比较浓缩样品中污染物带的聚集质量与稀释样品中蛋白蛋白蛋白带的质量来评估纯度。单链核酸酶在含有放射性标记的单链DNA底物的50 µL反应中确定,在37°C下孵育4小时4小时。双链外切核酸酶在50 µL反应中确定,该反应含有放射性标记的双链DNA底物和10 µL的酶溶液在37°C下孵育4小时。双链核酸内切酶在50 µL反应中确定,该反应含有0.5 µg质粒DNA和10 µL的酶溶液在37°C下孵育4小时。
腐蚀抑制剂
摘要 腐蚀是一种自然过程,在此过程中,纯金属或其合金转化为化学上更稳定的氧化物或硫化物或其他稳定形式。它是材料(通常是金属)通过与环境发生化学或电化学反应而逐渐劣化的过程。它给人类造成了巨大的损失,因此过去几十年来人们一直在研究解决这一仍然存在的现象的方法。各种技术都用于防止腐蚀,如电沉积、使用有机和无机腐蚀抑制剂、绿色有机抑制剂、离子液体等。大多数腐蚀抑制剂都是有效的,但它们要么价格昂贵,要么本质上有毒。其中一些是不可生物降解的。但在这方面,绿色有机腐蚀抑制剂被发现比其他抑制剂更好。它们唯一的问题是效率较低。因此,需要在该领域进行更深入的研究以提高其耐腐蚀能力。关键词:腐蚀抑制剂、腐蚀、离子液体、腐蚀电位、电流密度。
FPT抑制剂
指示:通过加入10毫升无菌蒸馏水来补充1个小瓶的含量。将小瓶倒置慢慢地慢慢地避免了两到三次避免起泡。或者,可以用无菌玻璃棒或搅拌器轻轻搅拌1-2分钟来溶解内容物。未获得立即溶解。保持其站立1-2个小时以更好地溶解。轻微的颗粒物,不会影响补充剂的性能参数。Aseptically add the supplement in 90 ml of sterile, molten Baird Parker Agar Base M043 / Baird Parker HiVeg™ Agar Base MV043 / Baird Parker Agar Base, Granulated GM043 / Baird Parker HiCynth™ Agar Base MCD043 / Baird Parker Agar Base (FPT) M1736 / RPF Agar Base M1736i冷却至48°C。与烧瓶同时轻轻旋转烧瓶,从烧瓶的侧面缓慢加入补充剂,以均匀地混合补充剂。倒入无菌培养皿中,立即使用。
P2Y1R 抑制剂
认知活力报告® 是由阿尔茨海默氏症药物发现基金会 (ADDF) 的神经科学家撰写的报告。这些科学报告包括对药物、在研药物、药物靶点、补充剂、营养品、食品/饮料、非药物干预和风险因素的分析。神经科学家评估对大脑健康的潜在益处(或危害),以及可能影响大脑健康的与年龄相关的健康问题(例如心血管疾病、癌症、糖尿病/代谢综合征)。此外,这些报告还包括对安全性数据的评估,这些数据来自临床试验(如果有)和临床前模型。P2Y1R 抑制剂证据摘要 P2Y1R 抑制具有抗血小板作用并可能防止兴奋性毒性,但由于其依赖于上下文的特性,存在相互矛盾的证据,并且模型的可翻译性尚不清楚。
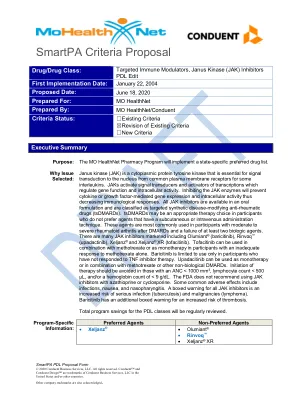
TIMS AS 抑制剂
Janus 激酶 (JAK) 是一种细胞质蛋白酪氨酸激酶,对于某些白细胞介素从常见的质膜受体向细胞核传递信号至关重要。JAK 激活信号转导和转录激活因子,从而调节基因功能和细胞内活性。抑制 JAK 酶将阻止细胞因子或生长因子介导的基因表达和细胞内活性,从而降低免疫反应。所有 JAK 抑制剂均以口服剂型提供,并被归类为靶向合成的改善病情的抗风湿药物 (tsDMARD)。对于不喜欢皮下或静脉给药技术的药物的患者,tsDMARD 可能是一种合适的治疗选择。这些药物最常用于 DMARD 治疗后且至少两种生物制剂治疗失败的中度至重度类风湿性关节炎患者。市场上有许多 JAK 抑制剂,包括 Olumiant ®(巴瑞替尼)、Rinvoq ™(upadactinib)、Xeljanz ® 和 Xeljanz ® XR(托法替尼)。托法替尼可与甲氨蝶呤联合使用,或作为单药疗法用于对甲氨蝶呤单药治疗反应不足的参与者。巴瑞替尼仅限于用于对 TNF 抑制剂治疗无反应的参与者。Upadacitinib 可作为单药疗法使用,或与甲氨蝶呤或其他非生物 DMARD 联合使用。ANC < 1000 mm 3 、淋巴细胞计数 < 500 µL 和/或血红蛋白计数 < 9 g/dL 的患者应避免开始治疗。FDA 不建议将 JAK 抑制剂与硫唑嘌呤或环孢菌素一起使用。一些常见的不良反应包括感染、恶心和鼻咽炎。所有 JAK 抑制剂均有黑框警告,即会增加严重感染(结核病)和恶性肿瘤(淋巴瘤)的风险。巴瑞替尼还有一项额外的黑框警告,即会增加血栓形成的风险。