XiaoMi-AI文件搜索系统
World File Search System摘要上下文:几种方法,例如抗体药物缀合物(ADC),嵌合抗原受体T细胞(CAR-T)和最近双特异性抗
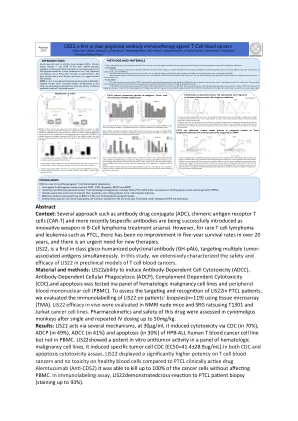
抽象的环境:几种方法,例如抗体药物缀合物(ADC),嵌合抗原受体T细胞(CAR-T)和最近的双特异性抗体,已成功引入了B细胞淋巴瘤治疗中的创新武器。但是,对于罕见的T细胞淋巴瘤和白血病(例如PTCL),五年内的五年生存率在20多年中没有提高,并且迫切需要新的疗法。lis22,是类糖 - 人性化的多克隆抗体(GH-PAB)的第一个,同时针对多种肿瘤相关的抗原。在这项研究中,我们广泛地表征了LIS22在T细胞血液癌的临床前模型中的安全性和功效。材料和方法:LIS22诱导抗体依赖性细胞毒性(ADCC),抗体依赖性细胞吞噬作用(ADCP),补体依赖性细胞毒性(CDC)和凋亡对血液学细胞细胞系和外围血液中的血液学细胞系和凋亡进行了测试。为了评估LIS22in PTCL患者的靶向和识别,我们使用组织微阵列(TMA)评估了LIS22对患者活检(n = 119)的免疫标记。LIS22的疗效。在单鼠猴子中评估了该药物的药代动力学和安全性,并重复发给50mg/kg。结果:LIS22通过几种机制起作用,以30µg/ml的速度起作用,它通过CDC(以70%),ADCP(以49%)的形式诱导细胞毒性,ADCC(分别为41%)(41%)和凋亡(分别为30%)HPB-All Human T血液癌细胞系,但在PBMC中不进行。它能够杀死多达100%的癌细胞而不会影响PBMC。lis22在血液学恶性细胞系中表现出有效的体外抗肿瘤活性,它诱导了特定的肿瘤细胞CDC(EC50 = 41.4±28.9Ug/ml)。均显示出对T细胞血液癌的效力明显更高,对健康血细胞的毒性没有毒性。在免疫标记测定中,对PTCL患者活检(染色高达93%)的LIS22示例性反应。
CAR-T 细胞疗法疫苗
1. Wudhikarn K, Perales MA。CD19 嵌合抗原受体 T 细胞治疗后的感染并发症、免疫重建和感染预防。骨髓移植。2022 年 10 月;57(10):1477-1488。doi: 10.1038/s41409-022-01756-w。2022 年 7 月 15 日电子版。PMID:35840746;PMCID:PMC9285870。2. Hill JA, Seo SK。如何预防接受 CD19 靶向嵌合抗原受体 T 细胞治疗 B 细胞恶性肿瘤患者的感染。血液。2020 年 8 月 20 日;136(8):925-935。doi: 10.1182/blood.2019004000。 PMID:32582924;PMCID:PMC7441168。3. Walti CS、Loes AN、Shuey K 等人。CAR-T 细胞治疗前后季节性流感疫苗的体液免疫原性:一项前瞻性观察研究。《癌症免疫治疗杂志》2021;9:e003428。doi:10.1136/jitc-2021-003428
内容 - 免费 IAS 准备
防止免疫细胞对自身细胞产生不当反应,即所谓的“自身免疫”反应;CAR-T 疗法:嵌合抗原受体 (CAR) - 受体蛋白经过改造,赋予 T 细胞针对特定抗原的新能力;修改 T 细胞以识别癌细胞;细胞毒性;
招标促销项目-Hamburg
该项目是关于在同种异体干细胞移植的背景下开发新的收养免疫疗法,尤其是条件。为此,应通过遗传和逆转录病毒转导来对NK细胞(原代NK细胞以及NK细胞系)进行基因修饰,以表达CD38和CD45建立的嵌合抗原受体(CARS)。
Cytovia 和 Cellectis 扩展其 TALEN® 基因编辑...
佛罗里达州阿文图拉和纽约州纽约市,2021 年 11 月 18 日——Cytovia Therapeutics, Inc. 是一家生物制药公司,正在开发同种异体“现成”基因编辑的 iNK(源自 iPSC 的 NK 细胞)和源自诱导多能干细胞 (iPSC) 和 Flex-NK™ 细胞接合器多功能抗体的 CAR(嵌合抗原受体)自然杀伤 (NK) 细胞,以及 Cellectis(Euronext Growth:ALCLS - 纳斯达克股票代码:CLLS),一家临床阶段的基因编辑公司,利用其核心技术开发基于基因编辑的产品,在免疫肿瘤学领域拥有一系列同种异体嵌合抗原受体 (CAR-)T 细胞,在其他适应症中拥有基因编辑的造血干细胞,今天宣布他们已经扩大了 TALEN® 基因编辑的 iPSC 衍生的 NK 和 CAR-NK 细胞的合作,以包括新的Cytovia 的合资实体 CytoLynx Therapeutics 在中国的 CAR 目标和开发。
P-BCMA-ALLO1(一种针对 B 细胞成熟抗原 (BCMA) 的同种异体嵌合抗原受体 T 细胞 (CAR-T) 疗法)在复发中的临床活性
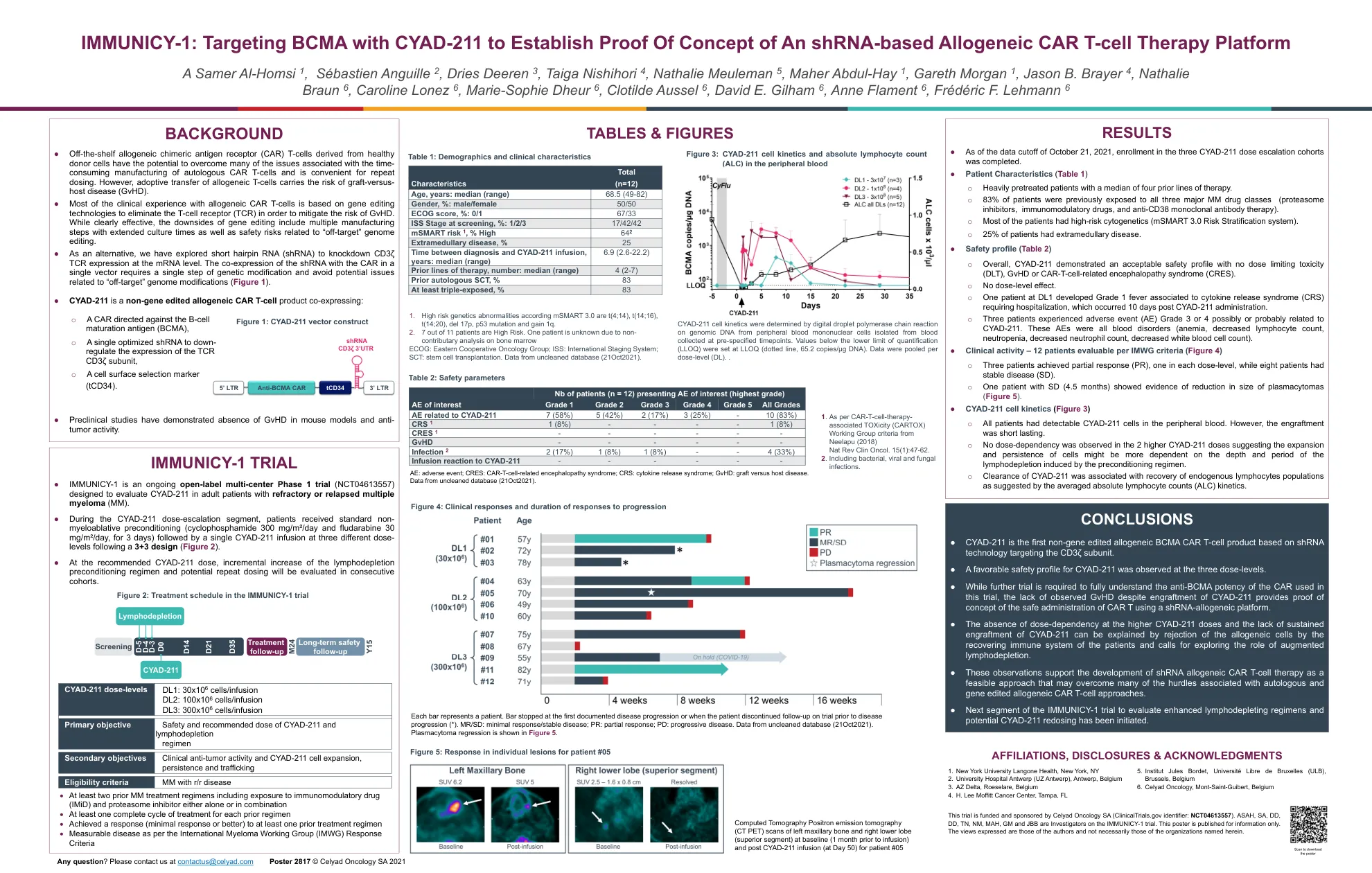
尽管治疗方法取得了进展,但多发性骨髓瘤仍然无法治愈。B 细胞成熟抗原 (BCMA) 是一种经过充分验证的骨髓瘤抗原,目前已批准多种靶向疗法。针对 BCMA 的免疫疗法,例如双特异性 T 细胞接合剂 (TCE) 和自体 CAR-T 可提供高反应率,但复发很常见。自体 CAR-T 在后勤方面具有挑战性,因为需要进行血液分离、制造时间延长且偶尔会出现制造故障。许多患者在等待自体 CAR-T 制造时病情进展并需要过渡治疗。一些患者在等待自体 CAR-T 制造时死于病情进展。TCE 因需要长期给药而受到阻碍,这在后勤方面具有挑战性。新兴数据还表明,自体 CAR-T 在接受 TCE 治疗后病情进展的患者中的临床活性较低。最后,在接受 BCMA 靶向免疫治疗后病情出现进展的患者是一个新兴的未满足需求领域,目前针对此类患者市售的治疗方法很少。
用汽车T细胞疗法靶向癌症
自体嵌合抗原受体(CAR)T细胞治疗是一种免疫疗法,通过重新编程其T细胞(或纤维细胞)识别并结合蛋白质(肿瘤相关的抗原),有可能与患者的免疫系统一起使用,并结合在某些细胞的表面上,包括癌细胞和/或健康的细胞表达tamor-Ast-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-Ass-AsscoccoccAckig。
IMMUNICY-1:利用 CYAD-211 靶向 BCMA,建立基于 shRNA 的同种异体 CAR-T 细胞治疗平台的概念验证
● 源自健康供体细胞的现成同种异体嵌合抗原受体 (CAR) T 细胞有可能克服自体 CAR T 细胞制造耗时带来的许多问题,并且便于重复给药。然而,同种异体 T 细胞的过继转移存在移植物抗宿主病 (GvHD) 的风险。
对肿瘤的制造CAR -NK -Chin J Cancer res
尽管嵌合抗原受体-T(CAR-T)细胞疗法在人类恶性肿瘤中具有显着的有效性,但它与众多挑战有关(1)。除了优化CAR-T细胞疗效外,自然杀手(NK)细胞的替代作用还引起了人们的重大兴趣。与CAR-T细胞相比,嵌合抗原受体受体(CAR-NK)细胞的独特特征突出了它们具有抗肿瘤功效的优势潜力(2)。除了CAR介导的细胞毒性外,NK细胞还可以通过NK特异性细胞毒性裂解具有下调或缺乏靶抗原的癌细胞,表明CAR-NK细胞是消除异质固体瘤的极好候选者(3)。CAR-NK治疗比CAR-T细胞疗法更安全,因为体内CAR-NK细胞的短期存活和独特的细胞因子谱(4)。“多个来源”是CAR-NK治疗的另一个重要优势。除了自体外周血衍生的NK细胞外,多个同种异体NK细胞进一步增强了制造现成的可能性
人口健康
摘要基于细胞的免疫疗法(CBIS),特别是用嵌合抗原受体(CAR)设计的T(CAR-T)细胞疗法来体现的,已成为癌症治疗的开创性方法。尽管如此,类似于其他各种治疗方式,肿瘤细胞采用了反策略来表现免疫逃避,从而规避了CBIS的影响。这种现象是由根植于肿瘤微环境(TME)内的复杂免疫抑制促进的。主要的机制是基于CBIS的肿瘤免疫逃避的主要机制,包括抗原的丧失,抗原呈递的下调,免疫检查点途径的激活,抗凋亡级联反应的启动以及免疫功能障碍和废气的诱导。在这篇综述中,我们深入研究了肿瘤细胞能够抵抗CBIS和提供前瞻性策略的能力的固有机制,以应对这些挑战。关键字免疫逃避,基于细胞的免疫疗法(CBI),嵌合抗原受体(CAR),CAR工具T(CAR-T)细胞治疗,肿瘤微环境(TME),免疫检查点蛋白,肿瘤异质性