XiaoMi-AI文件搜索系统
World File Search System1抑制O-GLCNAC转移酶激活I型... 环境影响如何以及何时会改变脑皮质?具有出生体重差异的双胞胎的实验培训研究 通过工程模式识别受体增强植物的广谱抗性 鉴定在上皮卵巢癌中具有治疗价值的新型RAN GTPase的抑制剂 细胞周期蛋白A/B RXL大环抑制剂以高E2F活性治疗癌症 DNA甲基化与转录噪声相关,响应于东部牡蛎(Crassostrea virginica)的PCO2升高 2分析:用于分析二维空间中脂质膜和生物聚合物的工具箱 全基因组CRISPR敲除屏幕揭示了猪基因组中必需基因的景观 细胞N-米尔司他酰转移酶是乳腺癌繁殖1 的必需 使用CRISPR-CAS12A 在DNA信息存储中随机消毒
105,也可以根据CC0许可使用。(未通过同行评审认证)是作者/资助者。本文是美国政府的工作。不受此前版本的版权持有人的版权,该版本于2024年6月11日发布。 https://doi.org/10.1101/2023.12.14.571787 doi:Biorxiv Preprint
使用可诱导 Cas12a 敲除筛选识别驱动上皮向间质转变的基因组合 Jun Lin (导师:Abhishek Iy
转移是指癌症扩散至不同器官。转移性肿瘤通常是致命的,并且难以通过常规手术或药物治疗¹。转移的一个关键前兆是上皮-间质转化 (EMT)。上皮细胞含有紧密连接并相互粘附。间质细胞是可移动细胞,可通过循环系统或其他身体系统迁移到身体的不同部位。癌症中的 EMT 是上皮癌细胞转变为间质样状态,从而导致癌症离体扩散至全身²。这些间质癌细胞可能定位到远处器官,在那里它可以进行间质-上皮转化 (MET) 形成肿瘤。EMT 通常是多个基因而非一个基因的结果,它们之间的复杂性尚不清楚³。更深入地研究 EMT 激活周围的基因网络将有助于提高对其机制和潜在疗法的认识。因此,必须进行更多研究来确定可导致 EMT 的基因组合。
抗死亡通路诱导作为 CRISPR/Cas-9 敲除结肠直肠癌细胞系的潜在靶向治疗
受调节的细胞死亡是一种基本的生物学过程,在维持组织稳态和消除受损或不必要的细胞方面起着至关重要的作用。铁死亡是一种铁依赖性过程,特征是氧化和受损脂质的积累,从而导致程序性细胞死亡。在调节这一过程的铁死亡途径基因中,可以考虑GPX4、TFRC、ACSL4、FSP1、SLC7A11 和 PROM2。有许多众所周知的铁死亡途径调节剂,本综述将对此进行讨论。不同组织来源的细胞对这些调节剂表现出敏感或抗性表型。在某些情况下,细胞治疗过程中会发生意外变化,表明可能存在调节死亡途径。我们假设细胞(尤其是结直肠癌细胞系)从铁敏感性转变为铁抗性可能是诱导化学抗性的结果。利用 CRISPR/Cas-9 基因组编辑等新技术,可以实现诱导表型“转换”。
CRISPR/Cas9 介导的番茄红素敲除
摘要:类胡萝卜素是一种有价值的色素,天然存在于所有光合植物和微藻以及某些真菌、细菌和古细菌中。绿色微藻形成了复杂的类胡萝卜素结构,适合高效采光和防光,并通过内源性 2-C-甲基-D-赤藓糖醇 4-磷酸 (MEP) 途径的强大功能具有强大的类胡萝卜素生产能力。先前的研究建立了成功的基因组编辑,并诱导了莱茵衣藻细胞类胡萝卜素含量的显著变化。本研究采用定制的类胡萝卜素途径来工程化生物生产有价值的酮类胡萝卜素虾青素。番茄红素 ε-环化酶 (LCYE) 的功能性敲除和基于非同源末端连接 (NHEJ) 的供体 DNA 在靶位点的整合会抑制 α-胡萝卜素的积累,从而抑制莱茵衣藻中丰富的类胡萝卜素叶黄素和氯黄素的积累,而不会改变细胞适应性。基于 PCR 的筛选表明,96 个再生候选系中有 4 个携带供体 DNA 的 (部分) 整合,并且 β-胡萝卜素以及衍生类胡萝卜素含量增加。与亲本菌株 UVM4 相比,Cr BKT、Pa crtB 和 Cr CHYB 的迭代过表达导致突变体 ∆ LCYE#3 (1.8 mg/L) 中的虾青素积累增加了 2.3 倍,这表明基因组编辑在设计用于虾青素生物生产的绿色细胞工厂方面具有潜力。
CLDN1 敲除角质形成细胞作为研究多种皮肤病的模型
图 2 CLDN1 敲除会降低 N/TERT-2G 单层细胞和器官型细胞浸没培养物中的屏障完整性。浸没单层细胞培养物在高 Ca 2 + 培养基中分化。通过 (A) 分化后 5 天内每天的跨上皮电阻 (TEER) 或 (B) 分化后 1、2 和 3 天的通透性测定来量化屏障功能。WT、pCLDN1 KO 和 A8 克隆细胞用于开发器官型培养物,并且 (C) 在提升到气液界面 10 天后测量电阻抗。-gRNA、pCLDN1 KO n = 4 个实验(A、B)。B6、A8、H1 克隆 n = 3 个实验和 D5 克隆 n = 1 个实验(A、B)。n = 3-9 个来自三个实验的总构建体,不同的符号代表各个实验(C)。通过配对 t 检验 (A、B) 或 ANOVA (A、B、C) 评估与相关 WT 对照的统计差异。数据以平均值 ± SEM 表示。 * p < 0.05,** p < 0.01。
通过 CRISPR/Cas9 基因敲除绵羊的 MSTNDel273C 突变促进骨骼肌肌纤维增生
。CC-BY 4.0 国际许可证可在未经同行评审认证的情况下获得)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。它是
miR396 基因敲除可增加大豆种子大小和产量
1. 安徽农业大学生命科学学院,合肥 230036,中国 2. 安徽农业大学前沿科学研究院生物育种技术研究中心,合肥 230036,中国 3. 百瑞生物技术有限公司,济南 250000,中国 4. 中国农业科学院作物科学研究所/国家南方研究院,农业农村部基因编辑技术重点实验室(海南),三亚 572025,中国 5. 南方科技大学,深圳 518055,中国 6. 海南省崖州湾种子实验室,三亚 572024,中国 † 这些作者对这项工作做出了同等贡献。 * 通信:朱建康(zhujk@sustech.edu.cn);朱建华(zhujh@ahau.edu.cn,朱博士全权负责与本文相关的所有材料的分发)
通过计算机设计 CRISPR/Cas9 引导 RNA 来敲除红薯 (Ipomoea batatas L.) 中的八氢番茄红素去饱和酶基因
摘要 本研究旨在设计计算机引导RNA(sgRNA),用于CRISPR/Cas9介导的红薯(Ipomoea batatas L.)八氢番茄红素脱氢酶(PDS)基因敲除。IbPDS基因编码区序列长1791个碱基对(bp),相当于572个氨基酸。将IbPDS基因的氨基酸序列与其他邻近植物物种的同源序列进行比较,结果显示,它与Ipomoea triloba和Ipomoea nil的PDS相似性很高,分别为98.60%和97.73%。 CRISPR RGEN Tools 为 IbPDS 基因提供了 113 个结果,筛选出 24 个,并选择了三个 sgRNA 序列用于设计基因编辑载体,它们是 sgRNA 1 (5'-AC- CTCATCAGTCACCCTGTCNGG-3')、sgRNA 2 (5'- CCTCCAGCAGCAGTATTGGTTGGTTTGNGG -3') 和 sgRNA 3 (5'- CTGAACTCTCCTGGTTGGTTGTTNGG -3')。所选 sgRNA 的预测二级结构为靶基因的基因编辑提供了有效的 sgRNA 结构。用于 CRISPR/Cas9 介导的 IbPDS 基因敲除的 PMH-Cas9- 3xsgRNA 载体是使用三个 sgRNA 序列和一个潮霉素抗性标记在计算机上设计的。
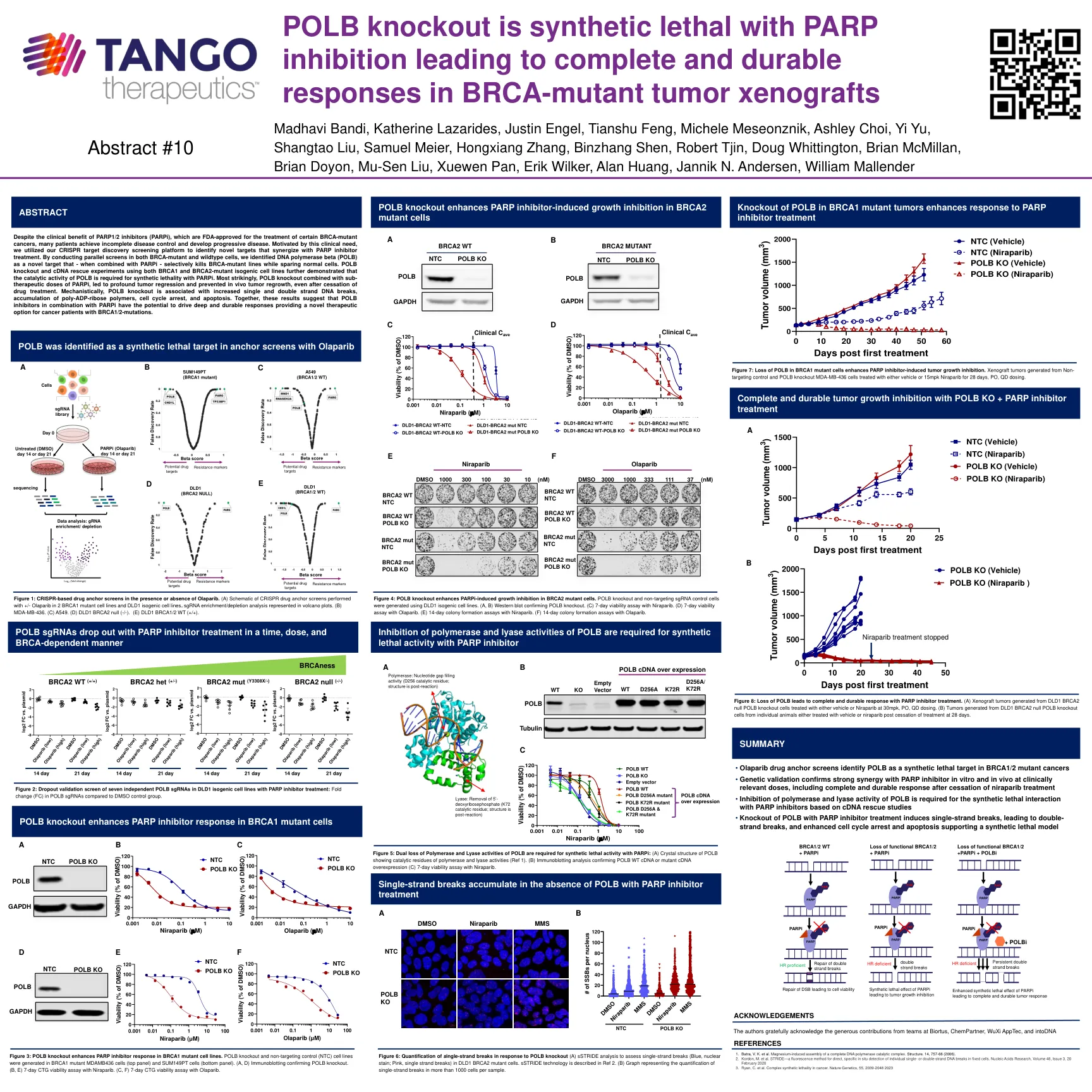
POLB敲除具有合成的致死性,并抑制了PARP,从而导致BRCA-突变肿瘤异种移植物的完整耐用反应
尽管PARP1/2抑制剂(PARPI)的临床益处是FDA批准用于治疗某些BRCA-突变癌的临床益处,但许多患者可以实现不完全的疾病控制和发展性疾病。是出于这种临床需求的激励,我们利用了CRISPR目标发现筛选平台来确定与PARP抑制剂治疗协同作用的新目标。通过在BRCA-突变剂和野生型细胞中进行平行筛选,我们将DNA聚合酶β(POLB)鉴定为一个新靶标,当与PARPI结合使用时,可以选择地杀死BRCA突变线,同时放大正常细胞。POLB敲除和使用BRCA1和BRCA2突变的同基因细胞系的cDNA救援实验进一步证明,PORB的催化活性对于与PARPI合成的致死性是必需的。最引人注目的是,POLB敲除与亚治疗剂量的PARPI结合,导致了深层肿瘤的消退,并阻止了体内肿瘤再生,即使停止药物治疗。从机械上讲,polb敲除与单链DNA断裂增加,多-ADP-核糖聚合物的积累,细胞周期停滞和凋亡有关。在一起,这些结果表明,POLB抑制剂与PARPI结合使用,有可能推动深层耐用的反应,为BRCA1/2突变的癌症患者提供了一种新型的治疗选择。
使用 RNAi 在中国仓鼠卵巢细胞中同时敲入/敲除 Caspase 8 相关蛋白 2 基因的时间和成本有效的基因组编辑方案
背景:CHO 细胞是生产生物制药的首选,而基因组编辑技术为提高重组蛋白产量提供了机会。靶向凋亡相关基因,如 Caspases 8 相关蛋白 2 (CASP8AP2),可提高 CHO 细胞的活力和生产力。将强大的策略与 CRISPR-Cas9 系统相结合使其能够应用于 CHO 细胞工程。目标:本研究旨在开发一种经济有效的方案,使用 CRISPR-Cas9 系统结合 HITI 策略同时在 CHO 细胞中缺失/插入 CASP8AP2 基因,并评估其对细胞活力和蛋白质表达的影响。材料和方法:我们通过将 CRISPR/Cas9 与 HITI 策略相结合,开发了一种有效的 CHO 细胞工程方案。使用 CHOPCHOP 软件设计了两个不同的 sgRNA 序列以靶向 CASP8AP2 基因的 3' UTR 区域。使用经济高效的 PEI 试剂将 gRNA 克隆到 PX459 和 PX460-1 载体中,并转染到 CHO 细胞中。采用手动选择系统简化单细胞克隆过程。MTT 测定评估 24、48 和 72 小时的基因沉默和细胞活力。流式细胞术评估 CASP8AP2 沉默的 CHO 细胞中的蛋白质表达。结果:研究证实了将 CRISPR-Cas9 与 HITI 策略相结合的稳健性,在产生敲除克隆方面实现了 60% 的高效率。PEI 转染成功地将构建体传递给近 65% 的克隆,其中大多数是纯合的。该方案被证明适用于资源有限的实验室,只需要倒置荧光显微镜。 CASP8AP2 敲除 (CHO-KO) 细胞经 NaBu 处理后,与 CHO-K1 细胞相比,其细胞存活率显著延长,48 小时时的 IC50 值分别为 7.28 mM 和 14.25 mM(P 值:24 小时 ≤ 0.0001,48 小时 ≤ 0.0001,P 值:72 小时 = 0.0007)。与天然细胞相比,CHO CASP8AP2 沉默细胞的 JRed 表达增加了 1.3 倍。结论:使用 CRISPR-Cas9 和 HITI 策略有效改造 CHO 细胞,同时进行 CASP8AP2 基因缺失/插入,从而提高细胞存活率和蛋白质表达。