XiaoMi-AI文件搜索系统
World File Search System提高药物研发能力,支持创新药物早日上市的战略目标和行动计划——实施
为实现上述目标,应为每项政策制定五年流程图,建立成果衡量指标(关键绩效指标 [KPI]),并提供后续行动以跟踪进展情况。此外,根据绩效目标(成果)的实现情况、政策措施的进展情况以及药物发现环境的任何变化,及时适当地审查流程图和 KPI。除了评估上述绩效目标外,还通过专家的综合评估实施后续行动。
附件‘B’批准用于……的新药清单(r-DNA来源)
未曾用甲氨蝶呤治疗的成人进行性类风湿性关节炎。 □依那西普单独使用或与甲氨蝶呤联合使用,已被证明可以降低 X 射线测量的关节损伤进展速度并改善身体功能。幼年特发性关节炎 (JIA) – □治疗对甲氨蝶呤反应不足或已证明不耐受甲氨蝶呤的 2 岁以上儿童和青少年的多关节炎(类风湿因子阳性或阴性)和扩大性少关节炎。□治疗对甲氨蝶呤反应不足或已证明不耐受甲氨蝶呤的 12 岁以上青少年的银屑病关节炎。□治疗对常规疗法反应不足或已证明不耐受常规疗法的 12 岁以上青少年的肌腱炎相关关节炎。□尚未对 2 岁以下儿童进行依那西普研究。银屑病关节炎(PsA)-治疗成人活动性和进行性银屑病关节炎,当先前的抗风湿药物治疗效果不佳时。依那西普已被证明可以改善银屑病关节炎患者的身体功能,并降低多关节对称亚型银屑病患者的外周关节损伤进展速度(通过 X 射线测量)。中轴型脊柱关节炎强直性脊柱炎 (AS)-治疗对常规疗法反应不足的严重活动性强直性脊柱炎成人。非放射学中轴型脊柱关节炎 (nr-AxSpA)-治疗对非甾体类药物反应不足的严重非放射学中轴型脊柱关节炎成人,其客观炎症体征为 C 反应蛋白 (CRP) 升高和/或磁共振成像 (MRI) 证据
附件'新药清单(R-DNA起源)批准为...
09-06-2016 IMP-88/2016 Nivolumab非小细胞肺癌(NSCLC):•Nivolumab作为单个药物被指示用于治疗局部晚期或转移性非小细胞肺癌(NSCLC)后的治疗(NSCLC)先前的化学疗法后(批准了09.09.09.09.06.06.06.2016.2016)。Nivolumab与ipilimumab结合使用,用于对成年患者的转移性非小细胞肺癌(NSCLC)的一线治疗,其肿瘤表达PD-L1(≥1%)通过经过验证的测试确定,没有EGFR或Alk基因组肿瘤差异(额外的INDICECTIC ON INDACITIC on 0.09.09.09.09.09.04.202)。 Nivolumab, in combination with ipilimumab and 2 cycles of platinum- doublet chemotherapy, is indicated for the first- line treatment of adult patients with metastatic or recurrent non-small cell lung cancer (NSCLC), with no EGFR or ALK genomic tumor aberrations (additional indication approved on 09.04.2021) 2) Renal cell carcinoma (RCC):
SOPP 8217:新药临床试验申请行政处理和审查管理程序 版本:5 生效日期:2017 年 7 月 5 日
答:联邦食品、药品和化妆品法案 (FD&C Act) 第 505 条规定,药品或生物制品必须获得食品和药物管理局 (FDA) 的上市批准,才能跨州运输或分销。IND 是赞助商向 FDA 提出的豁免此法律要求的请求。IND 用于临床研究,以收集安全性和有效性信息,以支持生物制品和药品的上市申请或医学研究。根据 21 CFR 312 子部分 I 中的扩展获取条款,当没有可比或令人满意的替代治疗方案时,IND 还用于在临床试验之外治疗患有立即危及生命的疾病或严重疾病或病症的患者。
晚上10点,致电1-833-740-3258或访问CareCompass.Quantum-Health。 主计长Sean Scanlon宣布与CVS 的新药房管理合同
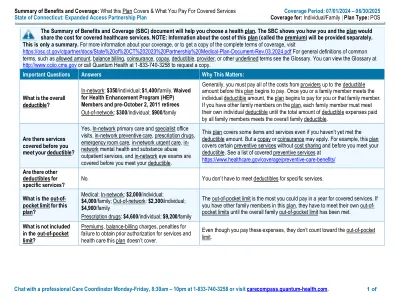
福利和承保范围(SBC)文件摘要将帮助您选择健康计划。SBC向您展示了您和计划将如何分享涵盖医疗服务的成本。注意:将单独提供有关此计划成本(称为保费)的信息。这只是一个摘要。有关您的覆盖范围的更多信息,或获取完整覆盖条款的副本,请访问https://osc.ct.gov/ctpartner/docs/docs/docs/state%20of%20ct 202023%202023%20partnhipmentmedical-plan-plan-document-plan-document-dibocument-revocument-rev.03.202.2024.pdf,例如常见条款,例如,允许copers coper cobay cobay cobay,例如销售,例如roply,sour coper cobay cobay coper coper,roply coper coper coper,例如提供者或其他下划线的术语请参见词汇表。您可以在http://www.cciio.cms.gov上查看词汇表,或致电1-833-740-3258致电量子健康,以请求副本。
Chewtadzy(Tadalafil) - 新药批准
- 他们定期和/或间歇性地使用任何形式的有机硝酸盐。- 对他达拉非或Chewtadzy的任何组成部分进行了已知的严重超敏反应,他们使用了鸟烯基环化酶刺激剂(例如riociguat)。•Chewtadzy的警告和预防措施包括心血管风险;每天服用Chewtadzy时,可能会发生药物相互作用;长时间的勃起和priapism;眼反应;突然的听力损失;低血压与α受体阻滞剂和抗高血压的使用;低血压与酒精同时使用;同时使用CYP3A4的有效抑制剂;与其他PDE5抑制剂或勃起功能障碍疗法结合;出血的影响;向患者提供有关性传播疾病的咨询;并在开始治疗BPH之前对其他泌尿外科条件的考虑。•用chewtadzy使用的最常见不良反应(≥2%)是头痛,消化不良,背痛,肌痛,鼻塞,鼻塞,冲洗和肢体疼痛。•建议在大多数患者中根据需要使用的Chewtadzy的推荐开始剂量是口服10 mg,在预期的性活动之前服用,不超过每天一次。
新药评估:Rezdiffra(resmetirom),口服片剂
新药评估:Rezdiffra (resmetirom),口服片剂 审查日期:2024 年 8 月 文献检索结束日期:初始 05/08/2024,重复 6/27/24 通用名称:Resmetirom 品牌名称(制造商):Rezdiffra (Madrigal Pharmaceuticals) 收到的档案:是 通俗语言摘要: 非酒精性脂肪性肝炎 (NASH) 是一种由脂肪堆积引起的肝病,它会损害没有其他已知肝病原因(例如酒精或丙型肝炎)的人的肝脏细胞。随着时间的推移,这会导致肝脏留下疤痕或不可逆转的损伤,甚至死亡。 非酒精性脂肪性肝炎在患有肥胖、2 型糖尿病、高胆固醇和高血压等其他健康状况的人群中更为常见。这些其他疾病有时被称为代谢综合征。 针对所有这些病症的药物和生活方式疗法是治疗非酒精性脂肪性肝炎的重要组成部分。 Resmetirom 是美国食品药品管理局 (FDA) 批准的首个用于治疗非酒精性脂肪性肝炎的药物。对于没有不可逆的严重肝脏瘢痕(如肝硬化)的非酒精性脂肪性肝炎患者,服用 resmetirom 至少一年后,部分患者的瘢痕(如纤维化)和其他肝病症状有所减轻。 生产 resmetirom 的公司正在研究这种药物,看它是否能减轻非酒精性脂肪性肝炎的其他严重影响,如死亡和肝功能衰竭。 腹泻和恶心是 resmetirom 最常见的副作用。 药物使用研究和管理小组建议提供者解释为什么有人需要 resmetirom,然后医疗补助才会支付费用。这个过程称为事先授权。研究问题:1. 目前诊断和治疗非酒精性脂肪性肝炎 (NASH) 的护理标准是什么?2. 对于患有中度至晚期肝纤维化的非酒精性脂肪性肝炎 (NASH) 患者,Resmetirom 的益处和危害是什么?3. 是否有特定的亚群对 Resmetirom 的耐受性更好或更有效?结论: NASH 是非酒精性脂肪性肝病 (NAFLD) 的一个子类别。肝活检是确诊所必需的,但可以使用非侵入性生化测试和成像技术(如纤维化-4 指数 (FIB-4)、弹性成像和增强肝纤维化 (ELF) 测试)进行连续筛查来评估纤维化分期和持续管理。1,2
Ohtuvayre™(Ensifentrine) - 新药批准
•在美国,大约有860万人接受COPD的治疗。•Ohtuvayre是磷酸二酯酶3和磷酸二酯酶4(PDE3和PDE4)的第一类选择性双抑制剂。抑制这两种酶都有支气管扩张剂和非甾体类抗炎作用。 •在两项随机的,双盲的,安慰剂对照研究(增强1和增强2)中,在总共1,553名中度至重度COPD的成年人中建立了疗效。 在这两项研究中,患者都接受了ohtuvayre或安慰剂。 在第12周后剂量后,曲线(AUC)0-12 h下的第一秒(FEV₁)区域的主要终点是强迫呼气量。抑制这两种酶都有支气管扩张剂和非甾体类抗炎作用。•在两项随机的,双盲的,安慰剂对照研究(增强1和增强2)中,在总共1,553名中度至重度COPD的成年人中建立了疗效。在这两项研究中,患者都接受了ohtuvayre或安慰剂。在第12周后剂量后,曲线(AUC)0-12 h下的第一秒(FEV₁)区域的主要终点是强迫呼气量。
自愿公告批准1类创新药物Enconalkib柠檬酸胶质胶囊“ Enconalkib(TQ-B3139)”
肺癌是一种恶性肿瘤,在中国和全球范围内发病率高和死亡率。 根据国家癌症中心于2022年发布的“中国癌症发病率和死亡率”的研究,中国新的肺癌的新病例每年达到828,000,死亡人数为每年657,000,其发病率和死亡率均在所有类型的癌症中都排名第一[2]。 在NSCLC患者中,ALK突变的发生率为3%〜7%。 随着中国人口的老龄化以及分子诊断和治疗技术的普及,新的ALK阳性NSCLC患者的诊断率逐年显示出趋势的增加[3]。 crizotinib是第一代ALK抑制剂,其功效明显优于化学疗法,但是疾病的进展仍然发生在几乎一半的患者中,患有大约1年的药物,而Crizotinib对中枢神经系统的穿透能力较弱,无法有效地控制脑部转移和发展脑中的效果,而又不限于脑部转移和发育。肺癌是一种恶性肿瘤,在中国和全球范围内发病率高和死亡率。根据国家癌症中心于2022年发布的“中国癌症发病率和死亡率”的研究,中国新的肺癌的新病例每年达到828,000,死亡人数为每年657,000,其发病率和死亡率均在所有类型的癌症中都排名第一[2]。在NSCLC患者中,ALK突变的发生率为3%〜7%。 随着中国人口的老龄化以及分子诊断和治疗技术的普及,新的ALK阳性NSCLC患者的诊断率逐年显示出趋势的增加[3]。 crizotinib是第一代ALK抑制剂,其功效明显优于化学疗法,但是疾病的进展仍然发生在几乎一半的患者中,患有大约1年的药物,而Crizotinib对中枢神经系统的穿透能力较弱,无法有效地控制脑部转移和发展脑中的效果,而又不限于脑部转移和发育。在NSCLC患者中,ALK突变的发生率为3%〜7%。随着中国人口的老龄化以及分子诊断和治疗技术的普及,新的ALK阳性NSCLC患者的诊断率逐年显示出趋势的增加[3]。crizotinib是第一代ALK抑制剂,其功效明显优于化学疗法,但是疾病的进展仍然发生在几乎一半的患者中,患有大约1年的药物,而Crizotinib对中枢神经系统的穿透能力较弱,无法有效地控制脑部转移和发展脑中的效果,而又不限于脑部转移和发育。