XiaoMi-AI文件搜索系统
World File Search System免疫检查点封锁:时间是一切
抽象的新辅助免疫疗法有效地使用原位肿瘤作为肿瘤抗原的储层来促进全身抗肿瘤免疫。研究表明,对免疫检查点抑制剂(ICI)的肿瘤内反应是由驻留在肿瘤中的居民记忆T细胞介导的,并且具有针对广泛的肿瘤抗原的特异性。ICI处理会在肿瘤和肿瘤淋巴结中的CD8 + T细胞从头启动,可以通过阻断可以关闭肿瘤内T细胞的抑制性检查点蛋白来增强抗肿瘤免疫反应。新辅助ICI治疗可以增强肿瘤内和全身性抗肿瘤免疫,包括扩展肿瘤内T细胞克隆,这与病理治疗反应密切相关。最近的数据表明,与单独的不可切除或晚期黑色素瘤患者的辅助ICI治疗相比,与单独的ICI治疗相比,对新辅助免疫疗法的病理反应率很高,生存率延长。这些数据表明,通过手术切除来清除肿瘤特异性T细胞的储存剂,并通过手术切除来排出淋巴结,可能会消除患者的抗肿瘤免疫力的很大一部分,并可能损害ICI结果。
免疫检查点抑制剂的有效性
目的立体定向放射外科 (SRS) 是治疗肾细胞癌 (RCC) 脑转移瘤 (BM) 的主要方法。近年来,免疫检查点抑制剂 (ICI) 已应用于转移性 RCC,并有助于改善预后。作者调查了 SRS 与同时进行的 ICI 对 RCC BM 治疗是否延长了总体生存期 (OS) 并改善了颅内疾病控制,以及是否存在任何安全问题。方法纳入了 2010 年 1 月至 2021 年 1 月期间在作者所在机构接受 RCC BM SRS 治疗的患者。同时使用 ICI 的定义是 SRS 和 ICI 给药之间间隔不超过 3 个月。使用基于倾向评分 (PS) 的逆概率治疗加权 (IPTW) 进行事件发生时间分析,以对接受和未接受 ICI 治疗 (分别为 ICI+SRS 和 SRS) 的患者进行 OS 和颅内无进展生存期 (IC-PFS) 分析,以控制选择偏倚。选择了四个基线协变量 (卡氏能力量表评分、颅外转移、血红蛋白和 BM 数量) 来计算 PS。结果 总共有 57 名患者符合条件,共有 147 个 RCC BM。所有患者的中位 OS 为 9.1 个月 (95% CI 6.0-18.9 个月),中位 IC-PFS 为 4.4 个月 (95% CI 3.1-6.8 个月)。12 名患者 (21%) 同时接受了 ICI。 ICI+SRS 组和 SRS 组经 IPTW 调整后的 1 年 OS 率分别为 66% 和 38%(HR 0.30,95% CI 0.13–0.69;p = 0.005),经 IPTW 调整后的 1 年 IC-PFS 率分别为 52% 和 16%(HR 0.30,95% CI 0.14–0.62;p = 0.001)。SRS 组 2 名患者在 SRS 治疗后立即出现严重肿瘤出血(不良事件常用术语标准 [CTCAE] 4 级或 5 级)。ICI+SRS 组 2 名患者和 SRS 组 5 名患者观察到 CTCAE 2 级或 3 级毒性。结论尽管患者数量较少且分析尚处于初步阶段,但本研究发现,对于 RCC BM 患者,SRS 联合同时进行的 ICI 可延长生存期并提供持久的颅内疾病控制,且治疗相关不良事件没有明显增加。
免疫检查点的最新进展及展望...
摘要:近年来,肝癌的发病率不断上升,目前是全球第六大常见肿瘤和第二大癌症相关死亡原因。大多数肝癌病例是肝细胞癌(HCC)。手术,包括肝移植或切除术,以及射频消融治疗都被认为是早期HCC的治愈性治疗方法。然而,大多数患者在诊断时已是晚期HCC,预后不良。因此,需要改进晚期HCC的治疗。免疫检查点抑制剂(ICI),其中程序性死亡受体1(PD-1)/PD-配体1和细胞毒性T淋巴细胞相关蛋白4是代表性的免疫检查点,在HCC治疗中显示出巨大的前景和进展。
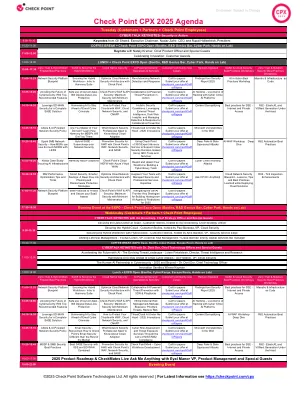
检查点CPX 2025议程
•网络会谈主题演讲-CPX是网络安全领导者和利益相关者的首映全球活动。听取行业最好和最聪明的消息。收集了来自多种有远见的演讲者的见解,他们传达了留下印象深刻的强大信息。•高管会议 - 发现动态会议,使您能够增强敏锐度和在不断发展的网络环境中的适应性。会议包括与检查点首席执行官兼创始人Gil Shwed的问答,交互式网络弹性策略和路线图圆桌会议以及CISO专家小组。•同行交流 - 认识志趣相投的高管,他们拥护网络安全。参与出色的CXO圆桌会议,参加定制的下一级活动,对同行的基准练习,并与充满活力的CXO社区分享您的想法。•CISO Connections(新) - 加入我们的轨道,该轨道专用于CISO,并由我们的检查点全局CISO团队•合作伙伴Track - 利用新合作伙伴轨道为您的客户提供最佳的安全性。
免疫检查点抑制剂和癌症 -
免疫检查点抑制剂(ICI)的出现是癌症治疗剂的para digm转移。ICIS靶标细胞死亡蛋白1(PD-1)或其配体(PD-L1)或细胞毒性T-Lym恐惧细胞相关蛋白4(CTLA-4)防止肿瘤免疫逃避。1,9美国食品药品管理局和欧洲药品局均批准了2011年的第一个ICI ipilimumab。10 ICI现在被广泛用于治疗肺癌,黑色素瘤,肾细胞癌,头颈癌和结直肠癌亚群。9,11对这些随机IZED对照试验(RCT)的荟萃分析发现,较低的1.1%[95%置信区间(CI)0.5-2.1] ATE的风险和中等2.7%(95%CI 1.8-4.4.0)的VTE风险。12个相似的速率(VTE率:黑色素瘤的1.5%,肺癌的1.9%)也通过对RCT进行的另一项荟萃分析以及对ICI在黑色素瘤和肺癌患有ICI使用的前瞻性研究表明。13
免疫检查点抑制剂的预后
抽象背景免疫检查点抑制剂(ICI)在过去十年中已转化了癌症治疗。随着这种治疗改进,出现了新的副作用,称为免疫相关的不良事件(IRAE),可能会影响任何器官。在这些伊拉斯中,心肌炎罕见,但威胁生命。我们进行了一项多中心横断面回顾性研究,目的是更好地表征与ICI相关的心肌炎。心肌炎诊断是基于国际心脏肿瘤学会的最新共识声明。结果从六个不同的推荐中心鉴定出29例患者。大多数患者(55%)使用抗序列性死亡1,而不是ICI组合(35%)或反编程1(10%)治疗。经胸膜超声心动图异常为52%,心脏磁共振在14/24例患者(58%)中显示出异常的特征。11例(38%)被归类为严重。与其他患者相比,他们患有更频繁的系统性自身免疫性疾病(45%vs 6%,P = 0.018),入院时肌钙蛋白水平较高(上极限为42倍,上限为3.55倍,P = 0.001),抗乙酰胆碱受体自身抗体(P = 0.001)(P = 0.001)。七名患者(24%)与心肌炎相关死亡,在随访期间又有八名患者死于癌症。28例患者接受了糖皮质激素,10例接受了血浆交换,8例接受了静脉内免疫球蛋白和其他5种免疫抑制剂。ICI补偿是在六名患者中进行的,其中只有1例心肌炎复发。讨论与ICI相关的心肌炎的管理可能具有挑战性,需要采用多学科方法。预后特征,并可能有助于在对福利 - 风险余额进行准确评估之后,为某些闷热表现的患者提供ICI补偿。
lag-3作为第三个检查点抑制剂
淋巴细胞激活基因3(LAG-3)是一种抑制受体,由耗尽的T细胞高度表达。lag-3是一个有希望的免疫治疗靶标,在临床试验中具有20多个lag-3靶向治疗剂,抗LAG-3和抗PD-1的固定剂量组合现在被批准治疗不可切除的或转移性黑色素瘤。尽管LAG-3被广泛认为是一种有效的抑制受体,但有关其生物学和作用机理的重要问题仍然存在。从这个角度来看,我们将重点放在理解LAG-3生物学方面的差距,并讨论当前辩论和关注点有关LAG-3的最大主题,包括其配体,信号和作用机理,其细胞特异性功能,其在不同疾病环境中的重要性以及新疗法的发展。
免疫检查点的抑制剂:小分子
摘要:癌症免疫疗法的革命进步,尤其是免疫检查点抑制剂的出现,标志着与恶性肿瘤的斗争中的重要里程碑。然而,大多数临床使用的免疫检查点抑制剂是单克隆抗体(mAB),具有多种局限性,例如口服生物利用度较差和免疫相关的不良反应(IRAE)。另一个主要局限性是对MAB对癌症患者的疗效的限制,这引发了广泛的研究工作,以识别旨在克服MAB限制效力的免疫检查点的替代方法。这项全面的综述旨在探索针对免疫检查点的尖端发展,重点是基于小分子和基于肽的方法。通过深入研究药物发现平台,我们提供了对识别和优化小分子和肽作为免疫检查点的抑制剂所采用的多种策略的见解。此外,我们讨论了纳米材料作为药物载体的最新进展,为开发基于小分子和肽的癌症免疫疗法的平台提供了基础。正在进行的研究重点是发现针对免疫检查点的小分子和受肽启发的药物为开发口服生物可用剂作为下一代癌症免疫疗法的方式铺平了道路。
5月4日 - 检查点检查员
6©2024 Check Point Software Technologies Ltd. 6©2023 Check Point Software Technologies Ltd.与完整网格和SD-WAN连接性的混合动力Sase