XiaoMi-AI文件搜索系统
World File Search System优化的 HDR 介导的 K-荧光蛋白敲入...
图 2:在 K-562 细胞中通过电穿孔优化 HDR 介导的报告基因敲入。A. LMNA -EGFP 供体质粒单独电穿孔,浓度增加,显示非特异性 EGFP 表达量较低。Cas9 蛋白:crRNA:tracrRNA 电穿孔,LMNA -EGFP 供体质粒浓度增加,显示 EGFP 表达相关增加。B. 放大倍数增加后,HDR 介导的敲入样本中 EGFP 表达的定位与 LMNA 的预期一致,位于细胞核中,并与 Hoechst 染色共定位。C. HDR 介导的敲入细胞群的流式细胞术分析显示,随着 DNA 供体质粒数量的增加,EGFP 表达增加高达 32%。单独 DNA 供体质粒对照的相应分析显示所有剂量的 EGFP 表达均低于 0.5%(未显示数据)。
基因组编辑-Alt -R为CAS12A(CPF1)超核酸酶-Net
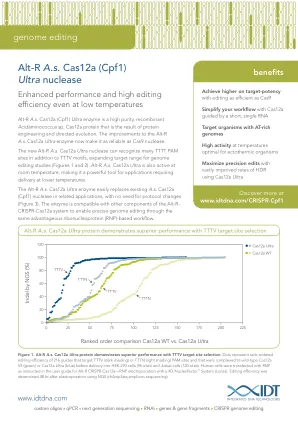
图1。Alt-R A.S. CAS12A超蛋白在TTTV目标位点选择方面表现出卓越的性能。 DOTS代表了216个指南的等级编辑效率,该指南靶向TTTV(深色阴影)或TTTN(浅色阴影)PAM站点,并且在输送到HEK-293细胞(96个位点)和陪同下(96个位点)和陪同细胞(96个位点)和野生型CAS12A V3(绿色)V3(绿色)或Cas12a Ultra(蓝色)。 如Alt-R CRISPR-CAS12A用户指南中所指示的RNP 人类细胞使用4D-Nucleofector™System(LONZA)的RNP电穿孔。 使用NGS(Rhampseq Amplicon测序)进行电穿孔后48小时编辑效率。Alt-R A.S. CAS12A超蛋白在TTTV目标位点选择方面表现出卓越的性能。DOTS代表了216个指南的等级编辑效率,该指南靶向TTTV(深色阴影)或TTTN(浅色阴影)PAM站点,并且在输送到HEK-293细胞(96个位点)和陪同下(96个位点)和陪同细胞(96个位点)和野生型CAS12A V3(绿色)V3(绿色)或Cas12a Ultra(蓝色)。人类细胞使用4D-Nucleofector™System(LONZA)的RNP电穿孔。使用NGS(Rhampseq Amplicon测序)进行电穿孔后48小时编辑效率。编辑效率。
实验动物
摘要:电穿孔动物基因敲除系统技术(TAKE)是一种简单有效的方法,利用成簇的规律间隔短回文重复序列(CRISPR)/CRISPR 相关蛋白 9(Cas9)系统生成转基因小鼠。为了增强电穿孔在小鼠基因编辑中的多功能性,针对玻璃化冷冻小鼠胚胎优化了电条件,并将其应用于广泛使用的近交系(C57BL/6NCr、BALB/cCrSlc、FVB/NJcl 和 C3H/HeJJcl)的新鲜胚胎。电脉冲设置(穿孔脉冲:电压,150 V;脉冲宽度,1.0 ms;脉冲间隔,50 ms;脉冲数,+4;转移脉冲:电压,20 V;脉冲宽度,50 ms;脉冲间隔,50 ms;脉冲数,±5)对于玻璃化冷冻加温的小鼠胚胎是最佳的,其可以有效地将 gRNA/Cas9 复合物递送到受精卵中而无需透明带变薄过程并编辑目标位点。这些电条件在广泛使用的近交系小鼠中有效地产生了转基因小鼠。此外,使用间隙为 5 mm 的电极进行电穿孔可以在 5 分钟内引入超过 100 个胚胎,而无需特殊的预处理和复杂的技术技能,例如显微注射,并且在产生的后代中表现出较高的胚胎发育率和基因组编辑效率,从而快速高效地产生基因组编辑小鼠。本研究中使用的电条件用途广泛,可以更轻松高效地生成转基因小鼠,有助于了解人类疾病和基因功能。关键词:CRISPR/Cas9、电穿孔、冻融胚胎、基因组编辑
优化电穿孔参数,使用 3 至 2000 kDA 的荧光葡聚糖将大分子有效递送至猪受精卵中
。CC-BY-NC-ND 4.0 国际许可证(未经同行评审认证)是作者/资助者,他已授予 bioRxiv 永久展示预印本的许可。
小鼠糖尿病诱导电穿孔介导的基因转移至啮齿动物胚胎组织IACUC标准程序生效日期:2024年5月描述:Elec
手术程序:将根据IACUC的啮齿动物生存手术指南制备怀孕(12.5-16.5 d后)女性的腹部。然后,将在皮肤和腹膜中进行腹部中线切口,长度约1.5厘米至2厘米,以暴露子宫角。应注意维持无菌的子宫和周围的组织,并用温暖的无菌盐水保持湿润。胚胎/胎儿可以使用纤维光通过子宫壁进行透射,以可视化受体组织。可视化目标区域的其他方式,例如超声。完成电穿孔程序后,子宫角将返回腹膜腔,切口将以两层关闭。完成电穿孔程序后,子宫角将返回腹膜腔,切口将以两层关闭。
8.01.61 前列腺癌局部治疗
0601T 消融,不可逆电穿孔;1 个或多个肿瘤,包括在荧光透视和超声引导下进行,开放性 0655T 经会阴局部激光消融恶性前列腺组织,包括经直肠