XiaoMi-AI文件搜索系统
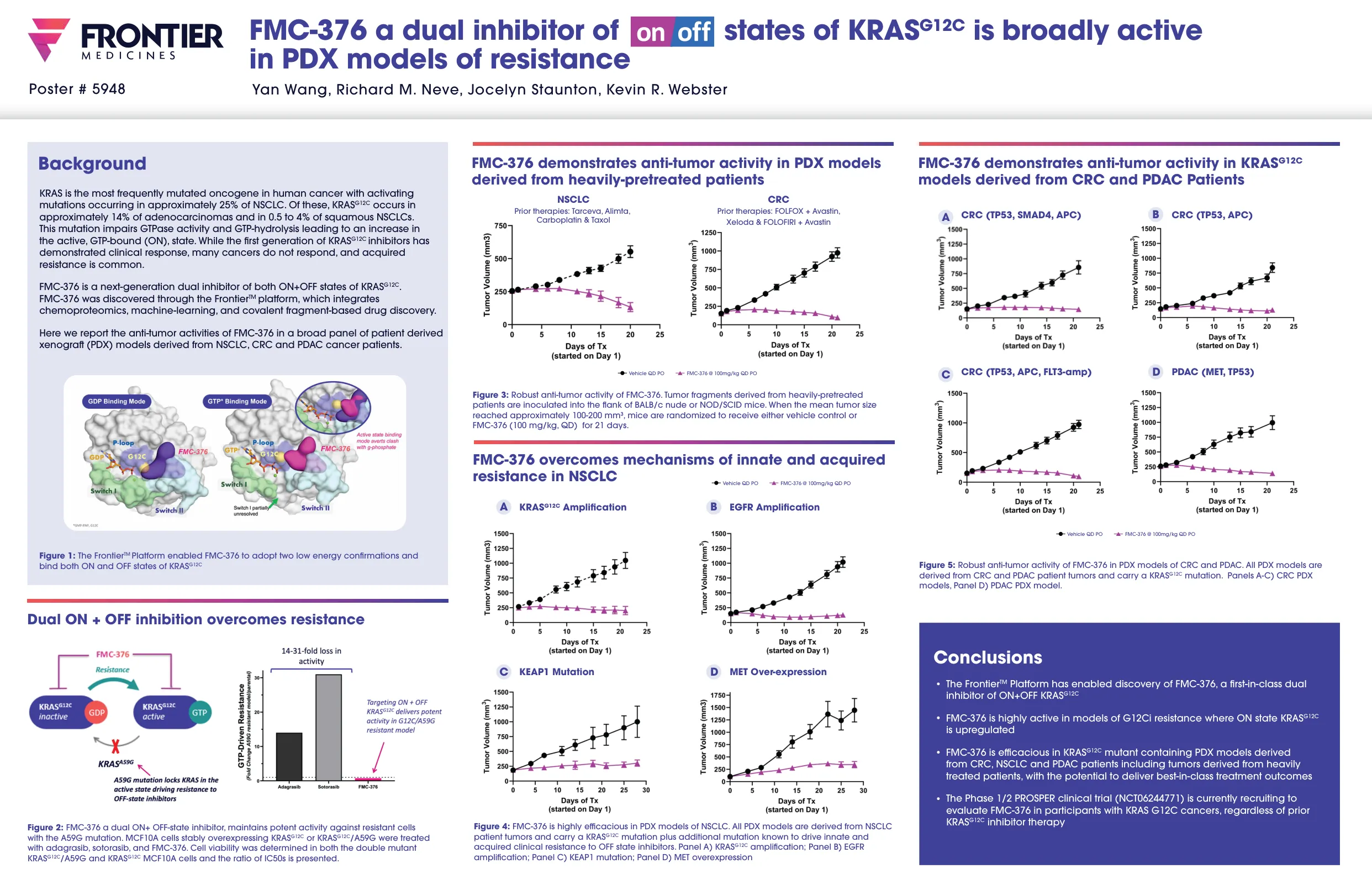
World File Search SystemFMC-376 KRASG12C状态的双重抑制剂广泛...
KRAS是人类癌症中最常见的癌基因,大约25%的NSCLC发生了激活突变。,KRAS G12C大约在腺癌的14%和0.5至4%的鳞状NSCLC中发生。该突变会损害GTPase活性和GTP - 溶解度,从而导致活性,GTP结合(ON)状态增加。虽然第一代KRAS G12C抑制剂表现出临床反应,但许多癌症没有反应,并且获得的耐药性很常见。
在选定的肿瘤性疾病中获得的血管性水肿
摘要:背景和目标。获得的血管性水肿是一种相对常见的启示,可促进某些疾病,例如自身免疫性或癌症。该研究旨在评估一种血管性水肿亚型-C1-INH-AEA(获得C1抑制剂降低的血管性水肿)的发生率。材料和方法。这项研究是回顾性的,基于112例乳腺癌,结直肠癌或肺癌的最终诊断患者:723名女性和589名男性平均年龄为58.2±13.5岁。根据ICD(国际疾病的国际分类)-10代码,包括TNM(肿瘤,淋巴结,转移)分期的病史,组织病理学以及C1-INH-AAE血管性水肿发生的评估的癌症诊断。结果。c1-Inh-aae在癌症患者中的发生率要比对照组的频率更高,如下所示:327(29%)vs. 53(6%)的p <0.05。C1-INH-AAE:197(37%)vs. 108(26%)对22(16%)(16%)(p <0.05)。在乳腺癌的早期阶段观察到C1-INH-AE的发生率更高。但是,C1-InH-AEA和BRCA1(乳腺癌基因1)/BRCA2(乳腺癌基因2)突变或乳腺癌组织病理学类型之间没有关系。结论。血管性水肿型C1-INH-AAE频繁发生在选定的肿瘤疾病患者中,尤其是在乳腺癌的早期阶段。
非...
摘要:在非小细胞肺癌(NSCLC)中已经确定了越来越多的驱动基因组改变,具有潜在的靶向治疗方法。对并发变化的发生率和不同分布的了解少得多,这是通过在癌基因成熟的NSCLC中进行的全面基因组培养所确定的。回顾性地收集了使用广泛的下一代测序面板连续分析的高级NSCLC的基因组数据。根据存在/不存在并发基因组畸变,对具有至少一个主要可起作基因改变的肿瘤进行了分类,以评估主要致癌基因中吸收的NSCLC之间的不同模式。在研究期间,在284名晚期NSCLC患者中鉴定出了三百九个可作用的基因改变。二十五个肿瘤样品(8%)在可起作的基因中表现出同时改变。共发生。总体上,在八个可起诉的基因组中观察到了并发变化数量的显着差异,TP53,STK11,循环和受体酪氨酸激酶(RTK)的分布分布。ngs对癌基因上瘾的NSCLCs的分析显示出不同的共同分布和模式。需要进一步的研究来评估这些并发变化的预后和治疗相关的影响,并挂在主要基因畸变中。
遗传的人类缺乏症会损害先天性和适应性免疫感染
我们报告了两个无关的成年人,具有纯合(P1)或复合杂合(P2)私人损失 - v -rel reticuloenculoisois病毒性癌基因癌基因同源物B(relb)的功能变异。功能性RERB的缺乏会损害患者成纤维细胞中淋巴细胞毒素的NFKB2 mRNA和NF -κB2(P100/p52)蛋白的诱导。这些缺陷是通过用野生 - 型RELB互补DNA(cDNA)转导的。相比之下,RELB缺乏成纤维细胞对肿瘤坏死因子(TNF)或IL -1β通过规范NF -κB途径的反应仍然完好无损。p1和p2具有较低的幼稚CD4 +和CD8 + T细胞以及记忆B细胞的比例较低。此外,其幼稚的B细胞无法区分为免疫球蛋白G(IgG)或免疫球蛋白A(IgA) - 响应CD40L/IL -21的分泌细胞,以及IL -17A/F的发育 - 产生T细胞在体外受到严重损害。最后,即使在造血干细胞移植后,患者即使在造血干细胞移植后也会产生中和自身抗体(IFNS),这证明了T细胞选择中胸上皮细胞的持久功能障碍,并对某些自身抗原的中心耐受性。因此,遗传的人类RERB缺乏破坏了替代NF -κB途径,其基础A的基础A和B细胞免疫缺陷与I型IFN的中和自动抗体一起赋予了对病毒,细菌和真菌感染的倾向。
两种预测肺腺癌预后的表型
肺癌患者的预后是由癌症阶段的组合定义的,该癌症定义了癌症的位置和扩散。患者的表现状况,是对耐受治疗能力的间接度量;最后,更具固有的肿瘤相关特性,例如局部免疫情节和肿瘤遗传构成。后两个决定免疫疗法和靶向药物是否是治疗选择。测量预后对患者和临床医生都很重要。为了使患者计划未来,并让临床医生预测临床轨迹可能会发生什么,从而及时地参与了相关的医疗保健专业人员。了解肿瘤的分子景观可以为两种治疗策略提供信息,并预测可能的肿瘤抗性途径(1)。当前有助于预测预后的工具是不精确的,尤其是对于肺腺癌,许多患者的病理学,基因突变和疾病阶段相似,但经历了大量多样的结果。腺癌是全球肺癌最常见的亚型(2)。诊断需要证据表明腺体分化,粘蛋白产生或肺细胞标志物表达(3)。肿瘤腺形成的形态和程度可以预测患者的结果(4-6)。cribiform,固体和微毛细血管生长模式具有不良的预后意义(4,7)。局部淋巴血管,顶胸膜和胸壁入侵类似地影响生存率(7)。早期肺腺癌治愈后的生存也有所不同(8)。肿瘤细胞的转移潜力很复杂,而不仅仅是肿瘤大小增加的功能。潜在的转录组/蛋白质组与肿瘤微环境一起控制了肿瘤过渡到迁移,因此转移性表型的能力(9)。作为一个社区,我们需要更好地预测肿瘤的未来行为,以指导治疗决策和预后。为例,使用另一个器官,可以用于雌激素阳性的HER2阴性乳腺癌。该测定法量化了乳腺癌复发的风险,并用于为化学疗法治疗决定提供信息(10)。重要的是,它能够预测那些在手术后将从辅助化疗中受益的患者,因为只有15%的雌激素阳性,HER2阴性乳腺癌患者在缺乏辅助化疗的情况下在5年时经历了复发(11)。超过一半的腺癌病例是由可靶向的癌基(12,13)驱动的,但正如已经突出的那样,即使在具有相同驾驶员癌的患者中,例如EGFR突变肿瘤,分子和临床异质性存在(14-16)。 尽管共享相同的癌基因,但可以通过包括基因内突变的位置的许多因素来解释多样化的患者结局。突变发生在肿瘤进化过程中的时机;肿瘤中存在多个驱动器突变;以及肿瘤的局部免疫环境(17)。 需要生物标志物来更好地预测治疗反应和预后。EGFR突变肿瘤,分子和临床异质性存在(14-16)。尽管共享相同的癌基因,但可以通过包括基因内突变的位置的许多因素来解释多样化的患者结局。突变发生在肿瘤进化过程中的时机;肿瘤中存在多个驱动器突变;以及肿瘤的局部免疫环境(17)。需要生物标志物来更好地预测治疗反应和预后。作为一个社区,我们必须挑战肺腺癌中的单一癌基因范式,该范式鼓励我们以相同的癌基因突变,以统一的方式治疗和关注患者。该区域很可能在临床上影响在“治愈”切除案例中协助辅助治疗决策;鉴于生存率的变化,真正的未满足需求(8)。
Accure™宿主细胞DNA定量试剂盒
可以在生物疗法生产过程中保留宿主细胞DNA,这构成了将癌基因和/或其他有问题的遗传物质转移到最终药物中的风险。为了最大程度地降低这种风险,监管机构将允许限制设置在10-100 pg/剂量之间,具体取决于所用的细胞系和给药方案。USP一般章<509>“残留DNA测试”建议将基于探针的DNA定量用作经过验证的方法,用于测试在大肠杆菌(E. coli)或中国仓鼠输卵管(CHO)细胞系中产生的重组治疗产品,以确保更好的敏感性和准确性。
Accure™宿主细胞DNA定量试剂盒
可以在生物疗法生产过程中保留宿主细胞DNA,这构成了将癌基因和/或其他有问题的遗传物质转移到最终药物中的风险。为了最大程度地降低这种风险,监管机构将允许限制设置在10-100 pg/剂量之间,具体取决于所用的细胞系和给药方案。USP一般章<509>“残留DNA测试”建议将基于探针的DNA定量用作经过验证的方法,用于测试在大肠杆菌(E. coli)或中国仓鼠输卵管(CHO)细胞系中产生的重组治疗产品,以确保更好的敏感性和准确性。
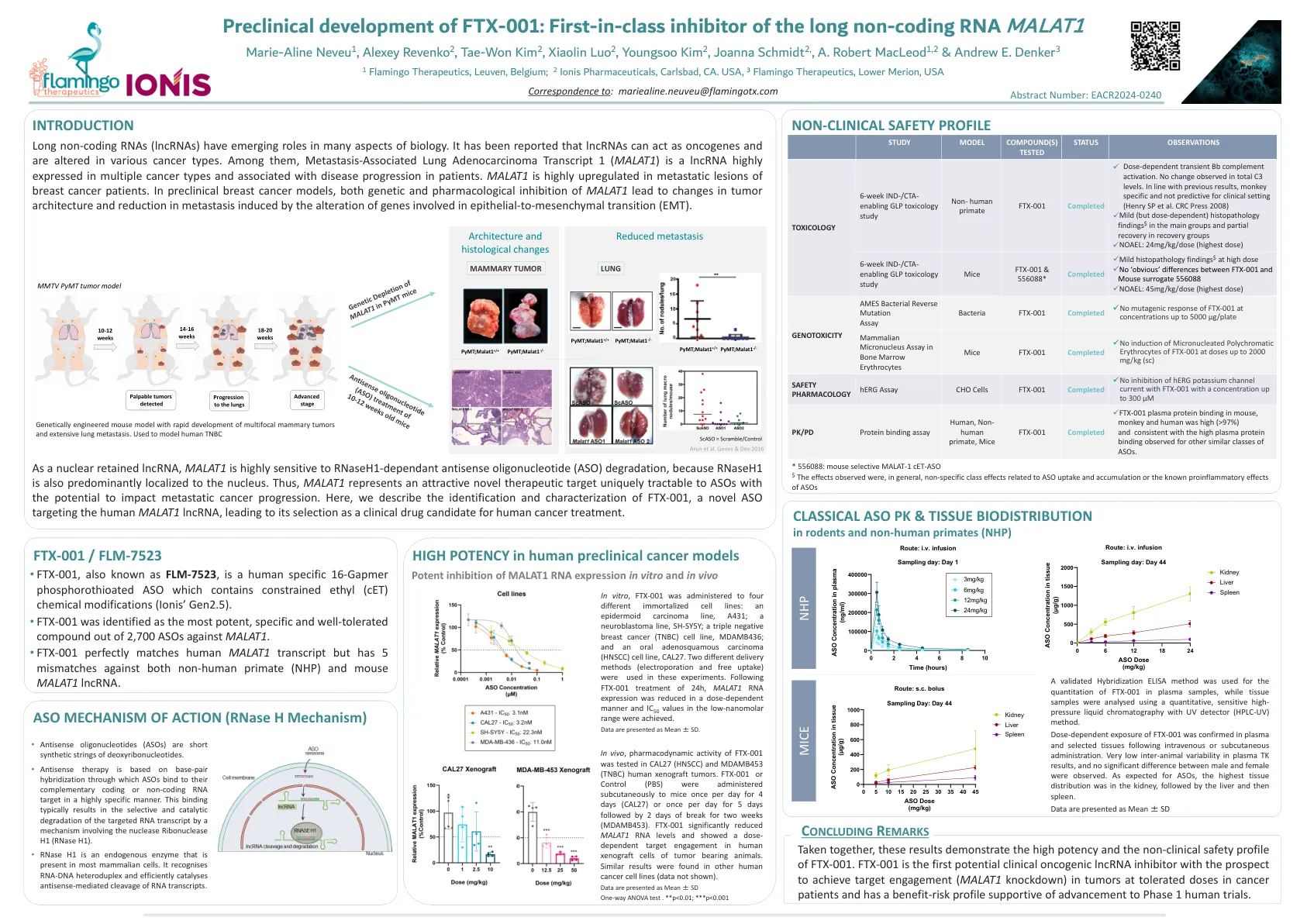
长的非编码RNA malat1
长的非编码RNA(LNCRNA)在生物学的许多方面都具有新兴的作用。据报道,lncRNA可以充当癌基因,并且在各种癌症类型中都改变了。其中,与转移相关的肺腺癌转录本1(Malat1)是一种高度表达的lncRNA,在多种癌症类型中,与患者的疾病进展有关。在乳腺癌患者的转移性病变中,Malat1高度上调。在临床前乳腺癌模型中,遗传学和药理抑制MALAT1导致肿瘤结构的变化以及涉及上皮 - 间质转变(EMT)的基因改变引起的转移的变化。